
 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g) ��H����196.64 kJ/mol�����ų�314��3 kJ����ʱ��SO2ת������ӽ��ڣ� ����
2SO3(g) ��H����196.64 kJ/mol�����ų�314��3 kJ����ʱ��SO2ת������ӽ��ڣ� ����| A��40% ���� | B��50% ���� | C��80%���� | D��90% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C��g������ 2 s ���� C ��Ũ��Ϊ 0.6 mol��L-1 ���������м���˵����
2C��g������ 2 s ���� C ��Ũ��Ϊ 0.6 mol��L-1 ���������м���˵����| A���٢� | B���ڢ� | C���٢� | D���ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ʵ���� | 1 | 2 | 3 | 4 | 5 |
| c(HI)/(mol��L��1) | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/(mol��L��1) | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/(mol��L��1��s��1) | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
| A��0.0380 mol��L��1��s��1 | B��0.152 mol��L��1��s��1 |
| C��0.608 mol��L��1��s��1 | D��0.760 mol��L��1��s��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ϡ���ᣬ����98��Ũ���� | B�����������Ȼ�ͭ��Һ |
| C����������������ˮ�������������� | D���������пƬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3���䷴Ӧ���ʷֱ�Ϊv(H2)��v(N2)��v(NH3)
2NH3���䷴Ӧ���ʷֱ�Ϊv(H2)��v(N2)��v(NH3) | A��v(H2)��v(N2)��v(NH3) | B��v(N2)��2v(NH3) |
| C��2v(H2)��3v(NH3) | D��v(N2)��3v(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��2Z(g)+2W(g)��2L�ܱ������н��У�5min��Y������0.5mol����˷�Ӧ��ƽ������vΪ�� ��
��2Z(g)+2W(g)��2L�ܱ������н��У�5min��Y������0.5mol����˷�Ӧ��ƽ������vΪ�� ��| A��V(X)=0.05mol��L��1��min��1 | B��V(Y)= 0.10mol��L��1��min��1 |
| C��V(Z)=0.10mol��L��1��min��1 | D��V(W)=0.05mol��L��1��s��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A��ʹ�øߴ��ȵ�п�� | B��ʹ��ŨH2SO4 |
| C��ʹ��С������п�� | D��ʹ��ŨHNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
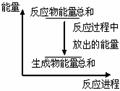
| A���䷴Ӧ��������ﶼ��������ʾ�÷�Ӧ������ |
| B����Ӧ������������ϵ������ͼ��ʾ |
| C�������÷�Ӧ��Ƴ�ԭ��أ�пΪ���� |
| D�������Ϊԭ��أ�����32.5gп�ܽ⣬�����ų������11.2L���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com