

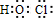 ,
,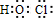 ;
;
| ||
| ||


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
| A、1.OL 1.0mo1?L-1的Na2CO3水溶液中含有的氧原子数为3NA |
| B、25℃时pH=13的NaOH溶液中含有Na+的数目为0.1NA |
| C、28g晶体硅中含有化学键的个数为2NA |
| D、1mol的羟基与1mol的氢氧根离子所含电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硼化钒-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时的反应为:4VB2+11O2═4B2O3+2V2O5,下列说法正确的是( )
硼化钒-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时的反应为:4VB2+11O2═4B2O3+2V2O5,下列说法正确的是( )| A、电极a是电源负极 |
| B、溶液中的OH向a极移动 |
| C、电子由VB2极经KOH溶液流向电极a |
| D、VB2极发生的电极反应为:2VB2+22OH-═V2O5+2B2O3+11H2O+22e- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g?L-1 |
| 排放标准 | pH 6~9 | 0.5mg?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
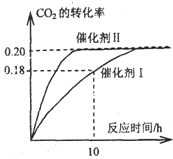 I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题:
I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2LH2O含有的分子数为0.5NA |
| B、含有NA个氦原子的氦气在标准状况下的体积约为l1.2L |
| C、25℃、l标准大气压下,64gSO2中含有的原子数为3NA |
| D、在常温常压下,11.2LCl2含有的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com