

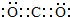 ;
; HClO+OH-;
HClO+OH-;分析 四种短周期元素A、B、C、D,由信息②可知,甲为水、乙为甲烷、丙为次氯酸,再根据信息①原子半径大小:A>B>C>D可得,A为Cl元素、B为碳元素、C为氧元素、D为氢元素.
(1)碳元素原子有2个电子层,最外层电子数为4,处于第2周期IVA族;
(2)CO2分子中碳原子与氧原子之间形成2对共用电子对;
(3)氯气与水反应生成HCl与HClO;
(4)NaClO溶液显碱性,因为ClO-水解使溶液中OH-浓度大于H+浓度;
(5)丁有H、O两种元素构成,且为18电子分子,则丁为H2O2.
①H2O2有强氧化性,可将浅绿色的Fe2+氧化为棕黄色的Fe3+;
②Fe3+是H2O2分解的催化剂;
③H2O2分解产生的热量促进了Fe3+水解,产生沉淀.
解答 解:四种短周期元素A、B、C、D,由信息②可知,甲为水、乙为甲烷、丙为次氯酸,再根据信息①原子半径大小:A>B>C>D可得,A为Cl元素、B为碳元素、C为氧元素、D为氢元素.
(1)碳元素原子有2个电子层,最外层电子数为4,处于第2周期IVA族,
故答案为:第2周期IVA族;
(2)CO2分子中碳原子与氧原子之间形成2对共用电子对,电子式为: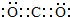 ,
,
故答案为: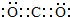 ;
;
(3)氯气与水反应生成HCl与HClO,反应离子方程式为:Cl2+H2O?H++Cl-+HClO,
故答案为:Cl2+H2O?H++Cl-+HClO;
(4)因为溶液中ClO-水解:ClO-+H2O
故答案为:碱;ClO-+H2O
(5)丁有H、O两种元素构成,且为18电子分子,则丁为H2O2.
①H2O2有强氧化性,发生反应2Fe2++H2O2+2H+=2Fe3++2H2O,浅绿色Fe2+被过氧化氢氧化成黄色Fe3+,
故答案为:发生反应2Fe2++H2O2+2H+=2Fe3++2H2O,浅绿色Fe2+被过氧化氢氧化成黄色Fe3+;
②过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈,
故答案为:过氧化氢分解可产生氧气,常温时反应2H2O2=2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈;
③溶液中存在平衡Fe3++2H2O?Fe(OH)3+3H+,反应①使c(H+)降低且反应②放热,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀,
故答案为:溶液中存在平衡Fe3++2H2O?Fe(OH)3+3H+,反应①使c(H+)降低且反应②放热,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.
点评 本题考查元素化合物推断,涉及常用化学用语、元素化合物性质、影响反应速率的影响与平衡移动,难度中等,推断元素是解题的关键,(5)解释是易错点,注意根据平衡移动分析.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 高温下焦炭还原二氧化硅制得粗硅 | |
| B. | 可用Na从TiCl4的水溶液中生产Ti | |
| C. | 可用CO高温下还原赤铁矿炼铁 | |
| D. | 可用石英、石灰石、纯碱在高温下生产玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液,pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | a mol/L HCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c( Na+)>c(CN-),则a 一定小于或等于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 将少量的H2S通入NaCN溶液中,反应为:H2S+2CN-=2HCN+S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
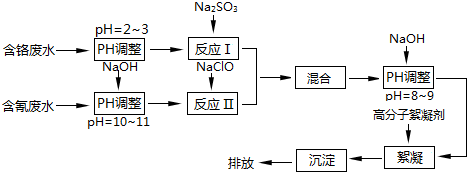
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.
④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
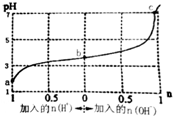
| A. | b点溶液中c(A-)>c(Na+)>c(HA) | |
| B. | 通入HCl后,c(HA)/c(A-)增大 | |
| C. | 当加入1 mol NaOH后,溶液中c(Na+)=c(A-) | |
| D. | a、b、c三点溶液中水的电离程度依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是制造太阳能电池板的主要材料 | |
| B. | NO、NO2是大气污染物,能在空气中稳定存在 | |
| C. | 漂白精的有效成分是Ca(ClO)2 | |
| D. | Fe与S化合生成Fe2S3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用碳酸钠与醋酸溶液制取少量二氧化碳 | |
| B. | 将NaHCO2与Al2(SO4)3两种溶液配制泡沫灭火剂 | |
| C. | 热的纯碱溶液的去污能力更强 | |
| D. | 实验室用饱和的FeCl3溶液制取氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0020 | 0.0032 | 0.0040 | 0.0040 |
| A. | 前20min的反应速率v(H2O)=2.5×10-5mol•L-1•min-1 | |
| B. | 达平衡时,至少需要从外界吸收的能量为0.968kJ | |
| C. | 增大c(H2O),可以提高水的分解率 | |
| D. | 使用纳米级Cu2O颗粒是为了提高催化效果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com