
| A、配制标准溶液时,固NaOH体中混有NaCl 杂质 |
| B、滴定终点读数时,俯视滴定管的刻度 |
| C、盛放未知液的锥形瓶用蒸馏水洗过,未用未知液体润洗 |
| D、配制NaOH标准溶液时,定容时俯视刻度线 |
| c(标准)×V(标准) |
| V(待测) |


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:
将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
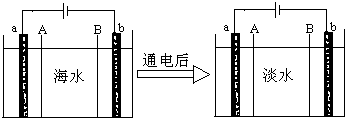 电渗析法将海水进行淡化,其原理如图.已知海水中含Na+、Cl-、Ca2+、Ba2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )
电渗析法将海水进行淡化,其原理如图.已知海水中含Na+、Cl-、Ca2+、Ba2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )| A、通电后,海水中阳离子往a电极处运动 |
| B、B膜是阴离子交换膜 |
| C、通电后,电子由b极经过溶液到达a极 |
| D、通电后,b电极上产生无色气体,溶液中少量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com