
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g) ΔH < 0
2N2(g)+3H2O(g) ΔH < 0
在恒容的密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.其他条件不变,充入惰性气体,正逆反应速率均不发生变化,平衡不移动
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
将固体A置于密闭容器中,在一定温度下发生下列反应:
①A(s)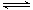 B(g)+C(g);②2C(g)
B(g)+C(g);②2C(g)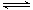 D(g)+E(g)。
D(g)+E(g)。
达到平衡时,c(D)=0.5mol·L-1,c(C)=4mol·L-1,则此温度下反应①的平衡常数为 ( )
A.25 B.20 C.16 D.9
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是
A.甲中水电离出来的H+的物质的量浓度是乙中水电离出来的H+的物质的量浓度的10倍
B.物质的量浓度c(甲)>10c(乙)
C.中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,V(甲)=10V(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
0.1 mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+。
CH3COO-+H+。
对于该平衡,下列叙述正确的是
A.加入水时,溶液中c(H+) 和c(OH—) 都减小
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol/L HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时,X、Y、Z的浓度分别为0.1 mol/L,0.3 mol/L,0.08 mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时,X、Y、Z的浓度分别为0.1 mol/L,0.3 mol/L,0.08 mol/L,则下列判断不合理的是
A.c1:c2= 1:3 B.X、Y的转化率相等
C.平衡时,Y和Z的生成速率之比为2:3
D.c1的取值范围为0<c1﹤0.14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
请认真观察右图,然后回答问题:
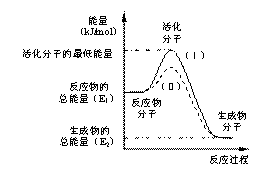 (1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应的△H=___________ (用含E1、E2的代数式表示)。
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应的△H=___________ (用含E1、E2的代数式表示)。
(2)已知热化学方程式:
H2(g)+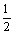 O2(g)= H2O(g)
O2(g)= H2O(g)
△H=-241.8 kJ/mol,
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为_______________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能 ,活化分子百分数 ,反应速率 ,(Ⅱ)相对(Ⅰ)改变的外界条件是_________。这一改变对反应热_________(填“有”、“无”)影响,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化
D.元素的化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、M、Z四种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素。下列说法不正确的是( )
A.化合物YZ3极易溶解于水
B.Z与M可以形成共价化合物
C.12 g 14X中含有质子的物质的量为6 mol
D.由上述四种元素组成的离子化合物受热易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子 B.1H218O与D216O的相对分子质量相同
C.H2O与D2O互称同素异形体 D.1H与D互称同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com