
【题目】LiAlH4是金属储氢材料,遇水剧烈反应释放出H2,LiAlH4在125℃时分解为LiH、H2和Al。下列说法正确的是( )
A.LiAlH4中Al的化合价为-5价
B.LiAlH4与水反应时,LiAlH4作还原剂
C.LiAlH4在125℃时完全分解,每生成2mol H2,转移电子数2NA个
D.LiH是反应的还原产物
【答案】B
【解析】
A.根据LiAlH4 中Li为+1价,H为-1价判断Al的化合价;
B.依据LiAlH4中的-1价H与H2O中的+1价H发生氧化还原反应生成H2判断;
C.依据LiAlH4在125℃分解为LiH、H2和Al的化学方程式计算;
D.根据反应前后元素化合价是否变化判断。
A.LiAlH4 中Li为+1价,H为-1价,则Al的化合价为+3价,A错误;
B.LiAlH4中的-1价H与H2O中的+1价H发生氧化还原反应生成H2,则LiAlH4中的-1价H化合价升高,作还原剂,B正确;
C.LiAlH4在125℃时分解为LiH、H2和Al。反应方程式为2LiAlH4![]() 2LiH+2Al+3H2↑。根据方程式和Al的化合价变化(+3→0)可知:2 mol LiAlH4在125℃时完全分解,转移6 mol电子,同时产生3molH2,则反应产生2molH2时,转移电子的物质的量是4mol,则转移电子数目为4NA,C错误;
2LiH+2Al+3H2↑。根据方程式和Al的化合价变化(+3→0)可知:2 mol LiAlH4在125℃时完全分解,转移6 mol电子,同时产生3molH2,则反应产生2molH2时,转移电子的物质的量是4mol,则转移电子数目为4NA,C错误;
D.在反应前LiAlH4中Li是+1价,H为-1价,反应后在LiH中Li是+1价,H为-1价,所以元素化合价未发生变化,则LiH不是氧化产物,也不是还原产物,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
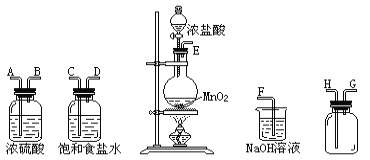
(1)连接上述仪器的正确顺序是:E接____,____接____,____接H,G接F。
(2)气体发生装置中进行的反应化学方程式是 ________;当足量的MnO2与2mol浓盐酸充分反应后(不考虑浓盐酸的挥发),得到的氯气的物质的量小于0.5mol的原因是__________。
(3)在装置中:①饱和食盐水的作用是______,②浓硫酸的作用是_____。
(4)化学实验中检验是否有Cl2产生常用_____,如果有Cl2产生,可观察到的现象是_________,写出反应方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)下列各化合物中,属于同系物的是_____,属于同分异构体的是___填入编号

![]()
F.戊烯和环戊烷
(2)反—2-丁烯的结构简式_________________________;
(3)2,6–二甲基–4–乙基辛烷的结构简式:_______;1mol该有机物完全燃烧耗氧气_______________mol。
(4) CH3-CH(C2H5) – C(C2H5)=CH-CH3的系统命名的名称为___________________;
(5)某烷烃分子里含有9个碳原子,且其一氯代物只有2种,则该烷烃的系统命名的名称是______。
(6)  单体的结构简式________________。
单体的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有主族元素A,B,C,D四种元素,原子序数依次递增,A元素原子2p轨道上有2个未成对电子。B原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D原子得一个电子填入3p轨道后,3p轨道为全充满。
请回答下列问题:
(1)AC2分子中含有______个π键,属于________分子(填“极性”或“非极性”)。
(2)B的氢化物的立体构型为____________,B原子的原子轨道采用________杂化。
(3)写出A的常见氧化物与B的氧化物中互为等电子体的一组物质:_______________________________。
(4)C元素的电负性________D元素的电负性(填“>”、“<”或“=”);用一个化学方程式表示:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,当溶液中离子浓度小于1×10-5mol·L-1时,可认为该离子沉淀完全。下列叙述正确的是( )
A. 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
B. 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
C. 向0.000 8 mol·L-1的K2CrO4溶液中加入等体积的0.002 mol·L-1AgNO3溶液,则CrO42-完全沉淀
D. 将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO4·7H2O)的工艺流程如下:

(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式________。
(2)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
(3)滤液中金属阳离子的检验方法__________。
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由____。(结合化学用语说明原因)
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:

已知总反应为:FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
①将过程I离子方程式补充完整
![]() _____
_____
②过程II反应的离子方程式__________。
③研究发现,用氧化亚铁硫杆菌(T.f)脱硫,温度过高脱硫效率降低(如图),可能的原因是____。

(6)绿矾晶体在空气中易被氧化。取X g样品,加水完全溶解,用酸化的amol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液b mL。反应原理:6Fe2++Cr2O72-+14H+ =6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为_____。(FeSO4·7H2O摩尔质量为278 g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)与H2(g)在铁催化剂表面经历如图所示过程生成NH3,下列说法正确的是
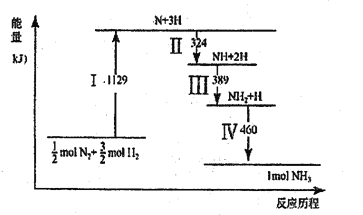
A. Ⅰ中破坏的均为极性键
B. Ⅱ、Ⅲ、Ⅳ均为放热过程
C. Ⅳ中NH2与H2生成NH3
D. N2(g)+3H2(g) ![]() 2NH3(g)ΔH>0
2NH3(g)ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重危害人类健康和生态环境,开发稳定高效的脱硫脱硝工艺技术是国内外研究的热点。研究表明,氮氧化物(NOx)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如下图所示。

(1)NH3的电子式是_________。
(2)NH4NO3溶液中的离子浓度由大到小顺序是_________。
(3)①已知:SO2生成SO3总反应方程式是
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol
此反应可通过如下两步完成:
2NO(g)+O2 (g ) ![]() 2NO2(g) ΔH1=-113 kJ/mol
2NO2(g) ΔH1=-113 kJ/mol
NO2(g)+SO2(g) ![]() SO3(g)+NO(g) ΔH2=_________。
SO3(g)+NO(g) ΔH2=_________。
② 一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1∶3,则NO2的平衡转化率是_________。
(4)利用NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。
① 制备少量NaClO2,其装置如下图所示:

装置I控制温度在35~55℃,通入SO2将NaClO3还原为ClO2(沸点:11℃),反应的离子方程式是_____________________________________________,
装置Ⅱ中反应生成NaClO2,此反应中作为氧化剂的是_______________,反应后溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有的一种阴离子是_______________。
② 用制得的NaClO2/H2O2酸性复合吸收剂同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如下图所示:


从上图中可知脱硫脱硝最佳条件是_________。图 中SO2的去除率随pH的增大而增大,而NO 的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳九芳烃是一种混合物,异丙苯就是其中的一种。工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下。下列有关说法正确的是
![]()
A. a的同分异构体有7种B. a能发生取代反应、加成反应和氧化反应
C. b的分子式为![]() D. b、c互为同系物
D. b、c互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com