
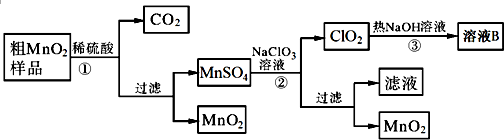


科目:高中化学 来源: 题型:
| A、①②③ | B、①②⑤⑥ |
| C、④⑤⑥ | D、②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
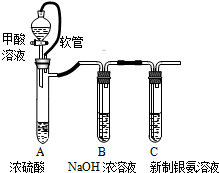 | 已知:银氨溶液制备反应为 Ag++2NH3?H2O═[Ag(NH3)2]++2H2O. 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
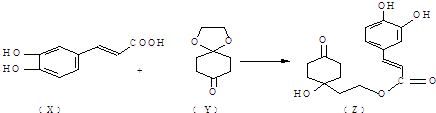
查看答案和解析>>
科目:高中化学 来源: 题型:
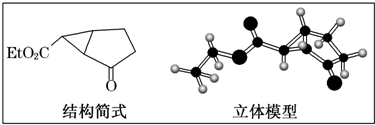
查看答案和解析>>
科目:高中化学 来源: 题型:
| 部分短周期元素的原子半径及主要化合价 | ||||||
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +5、-3 | -2 |
| A、GOH溶液和M(OH)3可以相互反应 |
| B、非金属性:T<Q |
| C、气态氢化物的稳定性:R>T |
| D、L2+与T2-核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质 |
| B、氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用 |
| C、乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-═2CO2↑+3H2O |
| D、KOH作电解质的甲烷燃料电池的正极反应为O2+2H2O+4e-═4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com