
【题目】将足量CO2通入KOH和Ca(OH)2的混合溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系如图所示:
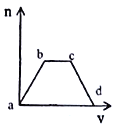
(1)ab段发生的离子反应方程式为_____________。
(2)bc段依次发生两个离子反应,首先是_________, 其次是___________。
(3)cd段发生的离子反应方程式是___________。
【答案】
(1)CO2+2OH-+Ca2+=CaCO3↓+H2O
(2)首先是CO2+2OH-=CO32-+ H2O,其次是CO2+CO32-+ H2O=2HCO3-
(3)CO2+H2O+CaCO3=Ca2++2HCO3-。
【解析】
试题分析:(1)一开始二氧化碳与氢氧化钙反应生成碳酸钙,此时沉淀质量增加,反应的方程式为CO2+2OH-+Ca2+=CaCO3↓+H2O,故答案为:CO2+2OH-+Ca2+=CaCO3↓+H2O;
(2)当二氧化碳和氢氧化钙反应完毕后,继续投入二氧化碳,二氧化碳与氢氧化钾的反应生成碳酸钾,如何继续与碳酸钾反应生成碳酸氢钾,离子反应方程式为CO2+2OH-=CO32-+ H2O,CO2+CO32-+ H2O=2HCO3-,故答案为:CO2+2OH-=CO32-+ H2O;CO2+CO32-+ H2O=2HCO3-;
(3)当把碳酸钾及氢氧化钾完全反应后,二氧化碳与碳酸钙反应生成了能够溶于水的碳酸氢钙,此时沉淀逐渐减少最后为零,反应的离子方程式为CO2+H2O+CaCO3=Ca2++2HCO3-,故答案为:CO2+H2O+CaCO3=Ca2++2HCO3-。


科目:高中化学 来源: 题型:
【题目】用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4·H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度。
(1)步骤Ⅰ中,滤渣的主要成分是 。
(2)将MnO2氧化Fe2+的离子方程式补充完整:
MnO2 + ![]() Fe2+ +
Fe2+ +![]() =
=![]() Mn2+ +
Mn2+ + ![]() Fe3+ +
Fe3+ +![]()
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 。
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 。
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度。
已知一定条件下,MnO4-与Mn2+反应生成MnO2 。取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 (用含x、y表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
选项 | 酸 | 碱 | 碱性氧化物 | 盐 |
A | H2CO3 | 纯碱 | CaO | 明矾 |
B | H2SO4 | 烧碱 | Na2O | 小苏打 |
C | HNO3 | 氨水 | Al2O3 | 石灰石 |
D | NaHCO3 | 熟石灰 | Al(OH)3 | 食盐 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍其中O2的质量分数为__________。若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为__________。
(2)相同条件下,某Cl2与O2混合气体100mL恰好与150mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为__________,混合气体的平均摩尔质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的说法中,不正确的是( )
A.实验后剩余的钠粒,需要放回原试剂瓶中
B.钠长期放置在空气中,最终将变成碳酸钠
C.钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中
D.当钠与硫酸铜溶液反应时,有大量红色固体铜出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法错误的是( )
A. 液化石油气主要含乙烯、丙烯和甲烷
B. 航空煤油中存在烷烃的同系物
C. 相同碳原子数的醇与卤代烃比较,醇在水中溶解度更大
D. 聚乙烯和聚甲基丙烯酸甲酯都是通过加聚反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组设计了如下图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物。请回答下列问题:

(1)实验开始时,欲使钠与水接触反应,应如何操作?_______________ 。
(2)反应开始后,试管中能观察到的实验现象是:________(填写代号)
A.钠在水层中反应熔成小球并四处游动
B.钠在两液体界面处反应熔成小球并可能作上下跳动
C.钠在水层中反应熔成小球并四处游动
D.钠不断地减小至消失
E.钠停留在煤油层中不反应
F.煤油中有气泡产生
(3)通过上述现象,能够验证钠的哪些物理性质:________________
(4)100 mL 容量瓶中盛有100mL0.101mol/L的BaCl2溶液,现欲将其稀释成浓度为0.100mol/L的BaCl2溶液(体积仍保持为100mL),所选用的仪器有:10mL量筒、1mL移液管(可准确移取0.10~1.00mL溶液)、胶头滴管。其简单的操作步骤是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列有关说法错误的是
A. SiO2、MgO熔点高,可用于制作耐高温仪器
B. 天然气是可再生清洁能源,可用于工业制盐酸
C. 硝酸铵属于氧化剂,严禁用可燃物(如纸袋)包装
D. 纤维素属于多糖类物质,但不能作人类的营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2N—NH2)是一种高能燃料,有关化学反应的为N2H4(g) + O2 = N2(g) + 2H2O(g) △H=-576 KJ/mol,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,H—O为463则断裂1molN—H键所需的能量(kJ)是( )
A.391 B.194 C.516 D.658
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com