
| A. | CuO+H2═Cu+H2O | B. | CuO+CO═CO2+Cu | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | Cu2(OH)2CO3═2CuO+H2O+CO2↑ |
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 用石墨作电极电解饱和食盐水时,若阴极得到2 NA个电子,则阳极产生22.4 L气体 | |
| B. | 2 L 0.05 mol•L-1乙酸溶液中H+数目为0.1 NA | |
| C. | 足量的Cu与含有0.2 mol H2SO4的浓硫酸共热可生成SO2为0.1 NA | |
| D. | 7.8 g Na2S 和Na2O2的混合物中,含有的阴离子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量大于生成物的总能量时,△H>0 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | △H的大小与热化学方程式中的各物质的化学计量数无关 | |
| D. | 在化学反应中,发生物质变化的同时一定发生能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 气体物质 | 主要来源 | 对环境的影响 | |
| A | 二氧化碳 | 化石燃料的燃烧 | 酸雨 |
| B | 二氧化氮 | 汽车尾气的排放 | 光化学烟雾 |
| C | 二氧化硫 | 工厂废气的排放 | 温室效应 |
| D | 一氧化碳 | 含酚醛树脂胶的人造板装饰材料 | 臭氧空洞 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CH2=CH2分子中,存在4个σ键和一个π键 | |
| B. | 在共价化合物中,一定存在极性键,可能存在非极性键,一定不存在离子键 | |
| C. | N、O、F电负性大小:F>O>N;第一电离能大小:F>O>N | |
| D. | 酸性强弱:H2SO4>H2SO3>H2SeO3;岩浆晶出的先后顺序:SiO2、MgSiO3、CaSiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=-1560.8 kJ/mol | |
| B. | 稳定性:正丁烷>异丁烷 | |
| C. | 正戊烷的燃烧热大于3531.3kJ/mol | |
| D. | 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
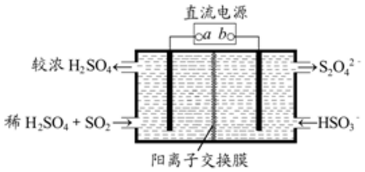 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液可吸收NO2.下列说法正确的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液可吸收NO2.下列说法正确的是( )| A. | a为直流电源的负极 | |
| B. | 与 b电极相连的电极反应式为:2HSO3-+2H++2e-═S2O42-+2H2O | |
| C. | 与 a相连的电极发生还原反应得到SO42- | |
| D. | 电解时,H+由阴极室通过阳离子交换膜到阳极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛.
氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com