
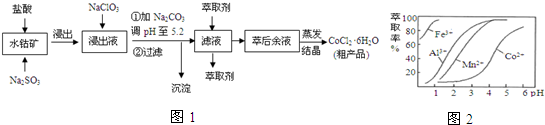
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
分析 含钴废料中加入盐酸和亚硫酸钠,Co2O3、Co(OH)3、Fe2O3、Al2O3、MnO和稀盐酸反应生成可溶性的CoCl2、AlCl3、FeCl2、MnCl2、NaCl,然后向溶液中加入氯酸钠,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,然后过滤,向滤液中加入萃取剂,将锰离子萃取,萃取后的溶液中主要含有CoCl2,为得到CoCl2•6H2O晶体,将溶液蒸发浓缩、冷却结晶而得到粗产品,
(1)浸出过程中Co2O3和亚硫酸钠发生氧化还原反应生成硫酸根离子和Co2+;
(2)NaClO3具有氧化性,能氧化亚铁离子生成铁离子;
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3沉淀;
(4)由表中数据可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(5)根据CoCl2•6H2O的组成分析,可能是含有杂质,也可能是失去部分水.
解答 解:含钴废料中加入盐酸和亚硫酸钠,Co2O3、Co(OH)3、Fe2O3、Al2O3、MnO和稀盐酸反应生成可溶性的CoCl2、AlCl3、FeCl2、MnCl2、NaCl,然后向溶液中加入氯酸钠,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,然后过滤,向滤液中加入萃取剂,将锰离子萃取,萃取后的溶液中主要含有CoCl2,为得到CoCl2•6H2O晶体,将溶液蒸发浓缩、冷却结晶而得到粗产品,
(1)亚硫酸根离子具有还原性,Co2O3具有氧化性,浸出过程中Co2O3和亚硫酸钠发生氧化还原反应生成硫酸根离子和Co2+,离子方程式为Co2O3+SO32-+4H+=2Co2++SO42-+2H2O,故答案为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)NaClO3具有氧化性,能氧化亚铁离子生成铁离子,氯酸根离子被还原生成氯离子,离子方程式为ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)加Na2CO3调pH至5.2,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
故答案为:Fe(OH)3、Al(OH)3;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知
调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去溶液中的Mn2+;B;
(5)根据CoCl2•6H2O的组成分析,造成产品中CoCl2•6H2O的质量分数大于100%的原因可能是:1、含有含氯离子的杂质,导致氯离子含量大,2、结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大,
故答案为:粗产品含有可溶性氯化物或晶体失去了部分结晶水.
点评 本题考查物质的分离和提纯,侧重考查学生分析判断能力,涉及氧化还原反应、离子反应、pH与沉淀的关系等知识点,为高频考点,明确流程图中发生的反应及基本操作是解本题关键,熟悉常见化合物的性质,题目难度中等.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:填空题
 +3HNO3 $→_{△}^{浓硫酸}$
+3HNO3 $→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n+3 | B. | n-4 | C. | n-6 | D. | n-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 出现白色沉淀 | 该溶液中一定含有SO42- |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有沉淀产生 | 蛋白质均发生变性 |
| D | 向某溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 该溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 离子半径:M->Z2->Y- | |
| B. | Z元素形成的氧化物都是共价化合物 | |
| C. | 气态氢化物稳定性:Y>Z>M | |
| D. | 三种元素中,M的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?N2O4 的△H>0 |
| D | 铝箔在酒精灯火焰上加热 | 铝箔熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
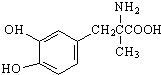
| A. | 1 mol甲基多巴的分子中含有4 mol双键 | |
| B. | 每个甲基多巴分子中含有一个手性碳原子 | |
| C. | 1 mol甲基多巴最多能与2 mol Br2发生取代反应 | |
| D. | 甲基多巴既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com