
【题目】(题文)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_________________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与10 mL 2 mol·L-1 NaOH溶液等体积混合而成,则溶液M的pH________(填“<”“>”或“=”)7,溶液中离子浓度由大到小的顺序为______________。已知Ksp(BaA)=1.8×10-10,向该溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为________mol·L-1。
(3)若有下列三种溶液:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合,则三种情况下,溶液中c(H2A)最大的是____________;pH由大到小的顺序为______________。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液中![]() =104,V1与V2的大小关系为________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
=104,V1与V2的大小关系为________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
【答案】H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2->c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)5.4×10-10③②>③>①均有可能
H++A2->c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)5.4×10-10③②>③>①均有可能
【解析】
(1)因为同时存在的分子有H2O、H2A,则H2A为弱酸;(2)等体积混合生成Na2A,为强碱弱酸盐,水解显碱性,A2-离子水解以第一步为主;(3)(1)弱酸电离,(2)中HA-水解生成分子,(3)中等体积混合为等量的NaCl、NaHA、H2A,抑制弱酸的电离;(4)混合溶液c(H+)/ c(OH-)=104, c(H+)=10-5mol/L,溶液显酸性,则酸过量,以此分析。
(1)因为同时存在的分子有H2O、H2A,则H2A为二元弱酸,电离方程式为H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-,因此,本题正确答案是: H2A
H++A2-,因此,本题正确答案是: H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-
H++A2-
(2)NaHA与NaOH以等物质的量反应后生成Na2A,由于A2-水解使溶液显碱性,所以pH>7;Na2A溶液中离子浓度的大小顺序为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);由离子方程式Ba2++A2-=BaA↓可得:反应后A2-过量0.01 mol,溶液中c(A2-)=![]() =
=![]() mol·L-1,根据BaA的Ksp可得:c(Ba2+)=
mol·L-1,根据BaA的Ksp可得:c(Ba2+)=![]() mol/L=5.4×10-10mol/L。本题答案为:>; c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) ;5.4×10-10。
mol/L=5.4×10-10mol/L。本题答案为:>; c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) ;5.4×10-10。
(3)③中溶质为物质的量浓度均为0.01 mol/L的NaCl、NaHA、H2A。NaHA、H2A相互抑制,弱酸电离程度较小,酸式酸根离子水解程度更小,所以这三种溶液中c(H2A)最大的为③;①为酸溶液,pH最小,②为盐溶液,③为酸和盐的混合溶液,所以pH③<②,则这三种溶液pH大小顺序是②>③>①。本题答案为:③ . ②>③>① 。
(4)混合溶液![]() =104,说明溶液呈酸性,则酸过量,H2A为弱酸,pH=3的H2A溶液与pH=11的NaOH溶液混合时酸的浓度大于碱的浓度,则二者体积关系不确定,大于、小于或等于都可能酸过量,因此,本题正确答案是:均有可能。
=104,说明溶液呈酸性,则酸过量,H2A为弱酸,pH=3的H2A溶液与pH=11的NaOH溶液混合时酸的浓度大于碱的浓度,则二者体积关系不确定,大于、小于或等于都可能酸过量,因此,本题正确答案是:均有可能。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是

A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于化合物的分离和提纯装置,请根据装置回答问题:
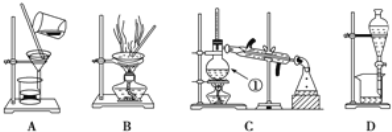
(1)装置B中被加热仪器的名称是________。装置C中①的名称是________。
(2)某硝酸钠固体中混有少量硫酸钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。
实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。
选择试剂 | ① | Na2CO3溶液 | ④ |
实验操作 | ② | ③ | 加热 |
所加入的试剂①可以是________(填化学式),证明溶液中SO42-已经除尽的操作是____________。加入Na2CO3溶液的目的是_________________________,所加入的试剂④是________(填化学式)。
(3)青蒿素是高效的抗疟疾药,为无色针状晶体,在乙醇、乙醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为:
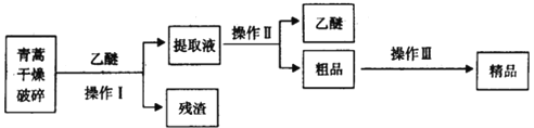
若要在实验室模拟上述工艺,操作I选择的实验装置是____(填代号),操作Ⅱ选择的实验装置是______(填代号)。操作Ⅲ的主要过程最可能是________(填字母):
A.加水溶解,蒸发浓缩、冷却结晶、过滤
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究物质的结构有助于对物质的性质进行研究。
(1)① 下列物质中含有羧基的是____(填字母)。
a.![]() b.
b.![]() c.
c.
② 下列物质分子中所有原子处于同一平面的是____(填字母)。
a.苯 b.丙烯 c.甲醇
③ 欲区分乙醛和乙酸,应选用____(填字母)。
a.NaOH溶液 b.HCl溶液 c.NaHCO3溶液
(2) 书写方程式并写出反应①和②的反应类型:
①甲烷与氯气在光照条件下的反应(写第一步)__________________;
②乙烯使溴水或溴的四氯化碳溶液褪色__________________;
③乙醇与金属钠的反应________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据表格中提供的甲、乙、丙、丁四种元素的相关信息完成下列问题:
元素 | 甲 | 乙 | 丙 | 丁 |
原子序数 | 11 | ③ | ||
元素符号 | ② | S | ||
原子结构示意图 | ① |
| ||
元素周期表中的位置 | 第三周期第ⅢA族 | ④ |
(1)填写表格中各序号所对应的空白:①_________________②__________________
③_________________④_________________。
(2)甲、乙、丙、丁四种元素中,原子半径最大的是____________(填元素符号),丁元素的最高正价为______________价。
(3)元素的最高价氧化物对应水化物中碱性最强的是_________(填化学式,下同), 呈两性的氢氧化物是__________________,酸性最强的是__________________。
(4)最高价氧化物对应水化物的碱性:甲_______________乙(填“>”或“<”),简单气态氢化物的稳定性:丙_______________丁(填“>”或“<”)。
(5)元素乙的最高价氧化物对应水化物,既能与元素甲的最高价氧化物对应水化物反应,又能中和过多的胃酸。请写出中和胃酸的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是

A.2H(g) +2X(g) == 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学反应的认识正确的是( )
A. 化学反应过程中,分子的种类和数目一定发生改变
B. 如果某化学反应的ΔH和ΔS均小于0,则反应一定能自发进行
C. 化学反应过程中,一定有化学键的断裂和形成
D. 放热反应的反应速率一定比吸热反应的反应速率快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系的表述中,正确的是
A. 0.1 mol·L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 中和pH和体积都相同的硝酸和醋酸溶液,消耗NaOH的物质的量之比为1∶1
C. 0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(H2CO3)
)>c(H2CO3)
D. pH=3的盐酸和pH=3的AlCl3溶液中,水电离出的c(H+)后者大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
A. Cu2+是H2O2分解反应的催化剂 B. H2O2只表现了氧化性
C. H2O2的电子式为: ![]() D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com