
下列溶液中Cl﹣浓度最大的是()
A. 1L 0.1mol•L﹣1的KCl溶液
B. 0.2L 0.1mol•L﹣1的盐酸溶液
C. 0.1L 0.1mol•L﹣1的AlCl3溶液
D. 0.3L 0.1mol•L﹣1的MgCl2溶液
考点: 物质的量浓度.
专题: 物质的量浓度和溶解度专题.
分析: 根据电解质离子的浓度=电解质浓度×电解质电离出该离子的数目,与溶液的体积无关,据此结合选项判断.
解答: 解:A、1L 0.1mol•L﹣1的KCl溶液中Cl﹣浓度为0.1mol/L×1=0.1mol/L;
B、0.2L 0.1mol•L﹣1的盐酸溶液中Cl﹣浓度为0.1mol/L×1=0.1mol/L;
C、0.1L 0.1mol•L﹣1的AlCl3溶液中Cl﹣浓度为0.1mol/L×3=0.3mol/L;
D、0.3L 0.1mol•L﹣1的MgCl2溶液中Cl﹣浓度为0.1mol/L×2=0.2mol/L;
故选:C.
点评: 本题考查物质的量浓度,比较基础,注意电解质溶液中离子的浓度与电解质浓度的计算.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
下列说法正确的是()
A. 凡是放热反应都是自发的,由于吸热反应都是非自发的
B. 自发反应一定是熵增大,非自发反应一定是熵减少或不变
C. 自发反应在恰当条件下才能实现
D. 自发反应在任何条件下都能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
(4)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=﹣41.3kJ•mol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度e.分离出二甲醚.
查看答案和解析>>
科目:高中化学 来源: 题型:
在研究金属钠与水的反应实验中,反应过程中所观察到的实验现象与金属钠的下列性质无关的是()
A. 熔点低 B. 密度小 C. 硬度小 D. 化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 摩尔是七个基本物理量之一
B. 常温常压下,0.1mol二氧化碳含有6.02×1022个CO2分子
C. 在标准状况下,22.4L水的质量约为18g
D. 22g二氧化碳与11.2LHCl含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
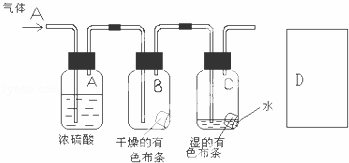
回答下列氯气的相关问题:
(1)将紫色石蕊试液滴入新制的氯水,现象是 ,起作用的微粒是 .
(2)某生应用下图所示方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:
①该项研究(实验)的主要目的是
②浓硫酸的作用是 .与研究目的直接相关的实验现象是
③从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是 .请在图D处以图的形式表明克服事故隐患的措施,写出化学方程式 .
(3)漂白粉是用Cl2与石灰乳反应来制取的,制取反应的化学方程式为 .漂白粉在空气中保存不当能失效,请用方程式表示原理 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某燃煤发电厂处理废气的装置示意图.下列说法错误的是()
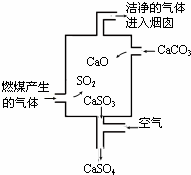
A. 使用此废气处理装置可减少酸雨的形成
B. 装置内发生的反应有化合、分解、置换和氧化还原反应
C. 整个过程的反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2
D. 若烟囱的气体排放不达标,则此气体可使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用如图中的装置可以实现该反应.
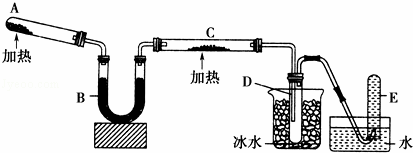
回答下列问题:
(1)A中发生反应的化学方程式是 .
(2)B中加入的干燥剂是(填序号)③①浓硫酸 ②无水氯化钙 ③碱石灰
(3)能证明氨与氧化铜反应的现象是①C中 ,②D中有无色液体生成设计实验检验D中无色液体的成分:取少量 粉末,现象为 .
(4)写出氨气与氧化铜反应化学方程式 若收集到2.24L(STP)氮气,计算转移电子数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42﹣;
4H++2Fe2++4SO42﹣;
②4Fe2++O2+4H+ 4Fe3++2H2O;
4Fe3++2H2O;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2
4H++2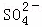 .
.
已知:FeS2中的铁元素为+2价.
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整.
(2)反应③的还原剂是 .
(3)观察上述反应,FeS2最终转化为 从煤炭中分离出来.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com