
| 2x |
| 3-x |
| 2x |
| 3-x |
| 2 |
| 3 |
| 2.06 |
| 3 |
| 200×2 |
| 137.3 |


科目:高中化学 来源: 题型:
| 4V |
| 3 |
| 4V |
| 3 |
| 4V |
| 3 |
| 4V |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
在537℃、1.01×105 Pa时,往容积可变的密闭容器中充入1 mol X和3 mol Y,此时容积为V L。保持恒温恒压,发生反应X(g)+3Y(g)![]() 2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
(1)达到平衡时,X的转化率约为 。
(2)保持上述温度和压强恒定不变,若向容器中只充入4 mol Z,则反应达到平衡时,平衡气体中Y 的体积分数为 ,容器的容积为 L。
(3)若另选一容积固定不变的密闭容器,仍控制温度不变,使2 mol X和6 mol Y反应,达到平衡时平衡气体中Z的体积分数仍为0.5,则该密闭容器的容积为 。
(4)若温度仍为537℃,容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01×105 Pa,若a: b = 1: 3,则a = 。
查看答案和解析>>
科目:高中化学 来源:浙江省五校2009-2010学年度高三第一次联考(化学)试题 题型:填空题
在537℃、1.01×105 Pa时,往容积可变的密闭容器中充入1 mol X和3 mol Y,此时容积为V L。保持恒温恒压,发生反应X(g)+3Y(g)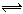 2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
(1)达到平衡时,X的转化率约为 。
(2)保持上述温度和压强恒定不变,若向容器中只充入4 mol Z,则反应达到平衡时,平衡气体中Y 的体积分数为 ,容器的容积为 L。
(3)若另选一容积固定不变的密闭容器,仍控制温度不变,使2 mol X和6 mol Y反应,达到平衡时平衡气体中Z的体积分数仍为0.5,则该密闭容器的容积为 。
(4)若温度仍为537℃,容器体积保持VL不变(恒容),往其中充入a mol X的b mol Y,使反应达到平衡,这时平衡气体中Z的体积分数仍为0.5,体系压强为1.01×105 Pa,若a: b = 1: 3,则a = 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com