
【题目】取钠﹣镁合金7.0克进行如下实验:
(1)写出Mg在CO2中燃烧的化学方程式
(2)向溶液1中加过量的NaOH溶液,发生反应的离子方程式为
(3)写出合金的化学组成 .
【答案】
(1)2Mg+CO2 ![]() 2MgO+C
2MgO+C
(2)H++OH﹣=H2O、Mg2++2OH﹣=Mg(OH)2↓
(3)Na2Mg
【解析】解:(1)Mg在CO2中燃烧生成氧化镁和单质炭,化学反应方程式为2Mg+CO2 ![]() 2MgO+C,故答案为:2Mg+CO2
2MgO+C,故答案为:2Mg+CO2 ![]() 2MgO+C;(2)向溶液1中加过量的NaOH溶液,首先发生氢离子与氢氧根离子反应,再发生镁离子与氢氧根离子反应生成氢氧化镁,离子反应方程式分别为:H++OH﹣=H2O;Mg2++2OH﹣=Mg(OH)2↓,故答案为:H++OH﹣=H2O、Mg2++2OH﹣=Mg(OH)2↓;
2MgO+C;(2)向溶液1中加过量的NaOH溶液,首先发生氢离子与氢氧根离子反应,再发生镁离子与氢氧根离子反应生成氢氧化镁,离子反应方程式分别为:H++OH﹣=H2O;Mg2++2OH﹣=Mg(OH)2↓,故答案为:H++OH﹣=H2O、Mg2++2OH﹣=Mg(OH)2↓;
(3)设钠的物质的量为xmol,镁的物质的量为ymol, 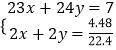 ,解之得:
,解之得: ![]() ,则合金的化学组成为:Na2Mg.
,则合金的化学组成为:Na2Mg.
故答案为:Na2Mg.
(1)金属镁属于活泼金属,能够与二氧化碳发生氧化还原反应;
(2)加入的氢氧化钠首先与过量的酸反应,然后再与镁离子发生反应生成沉淀;
(3)根据金属的质量和生成气体的体积联立方程组计算钠和镁的物质的量之比,然后得出合金的组成即可.


科目:高中化学 来源: 题型:
【题目】无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3 , 查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
探究一 无水AlCl3的实验室制备
利用如图装置,用干燥、纯净的氯气在加热条件下与铝粉(已除去氧化膜)反应制取无水AlCl3 . 供选择的药品:①铝粉 ②浓硫酸 ③稀盐酸 ④饱和食盐水 ⑤二氧化锰粉末 ⑥无水氯化钙 ⑦稀硫酸 ⑧浓盐酸 ⑨氢氧化钠溶液
(1)写出装置A烧瓶中发生的反应方程式 .
(2)实验开始前,先检查装置气密性,后装入药品,接下来的步骤依次是(填序号)
a.加热D中硬质玻璃管 b.往A烧瓶中加入液体 c.点燃A中的酒精灯
(3)写出无水AlCl3与水蒸气反应的化学方程式 .
探究二 无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如表:
第一次实验 | 第二次实验 | 第三次实验 | |
D中固体用量 | 2.0g | 2.0g | 2.0g |
氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
(4)根据表中数据,计算所得固体中无水AlCl3的质量分数 .
(5)有同学认为测得的无水AlCl3的质量分数偏低,你认为可能的原因有:(填序号)
①制备的氯气不足,②固体和气体无法充分接触,③无水AlCl3发生升华,造成损失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是( )
A.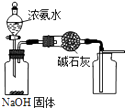
用图装置制取干燥纯净的NH3
B.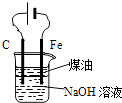
用图装置实验室制备Fe(OH)2
C.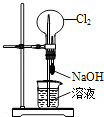
用图装置可以完成“喷泉”实验
D.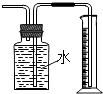
用图装置测量Cu与浓硝酸反应产生气体的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在乙烯分子中有5个σ键、一个π键,它们分别是( )
A.C﹣H之间只是sp2形成的σ键,C﹣C之间只是未参加杂化的2p轨道形成的π键
B.C﹣C间是sp2形成的σ键,C﹣H之间是未参加杂化的2p轨道形成的π键
C.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
D.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质或离子在指定分散系中能大量共存的是( )
A.Ca(ClO)2溶液中:K+、Na+、NO3-、Cl-
B.Fe(OH)3胶体中:Na+、H+、Cl-、I-
C.空气中:H2、HCl、NO、NH3
D.无色透明溶液中:K+、Na+、MnO4-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的化学性质与实际应用对应关系正确的是( )
化学性质 | 实际应用 | |
A | NH3具有碱性 | 用作制冷剂 |
B | SO2是酸性氧化物 | 用于纸张漂白 |
C | 漂白粉具有氧化性 | 用于漂白织物 |
D | FeCl3能与碱溶液反应 | 用于蚀刻铜制线路板 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘,有甲、乙两种实验方案如图1:已知:3I2+6NaOH=5NaI+NaIO3+3H2O.请回答: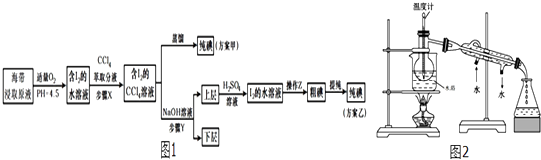
(1)步骤X使用分液漏斗前须检漏,检漏方法为 .
(2)用图所示装置进行蒸馏.指出如图所示实验装置 中的任意两处错误:① .
(3)进行上述操作时,使用水浴加热更好的原因是;最后碘晶体在里聚集.
(4)下列有关步骤Y的说法,正确的是 .
A.应控制 NaOH 溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH 溶液可以由乙醇代替
(5)方案乙在上层溶液中加入H2SO4溶液得到I2的水溶液发生的反应方程式是:;
(6)操作Z的名称是 .
(7)工业中采用方案乙从海带中提取碘,方案甲中采用蒸馏不合理,理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是
类别 组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | A12O3 | H2SO4 | KOH | NaHCO3 |
B | CO | Na2O | HC1 | NaOH | NaCl |
C | SO2 | Na2O2 | CH3COOH | Na2CO3 | CaF2 |
D | SO3 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe3+、K+、ClO﹣ 都可在该物质的溶液中大量共存
B.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
C.向0.1molL﹣1该物质的溶液中逐滴滴加0.1molL﹣1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示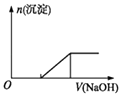
D.向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+2Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com