
| A£® | µČÖŹĮæµÄĮņÕōĘųŗĶĮņ¹ĢĢå·Ö±šĶźČ«Č¼ÉÕ£¬ŗóÕ߷ųöµÄČČĮæ¶ą | |
| B£® | ÓÉC£Ø½šøÕŹÆ£¬s£©=C£ØŹÆÄ«£¬s£©”÷H=-1.90 kJ/molæÉÖŖ£¬½šøÕŹÆ±ČŹÆÄ«ĪČ¶Ø | |
| C£® | ĒāĘųµÄČ¼ÉÕČČ285.8kJ/mol£¬ĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ 2H2£Øg£©+O2£Øg£©=2H2O£Øl£©”÷H=+285.8 kJ/mol | |
| D£® | ĒāŃõ»Æ±µ¾§ĢåÓėĀČ»Æļ§¾§Ģå»ģŗĻĪüČČ£¬·“Ó¦ĪļµÄ×ܼüÄÜÖ®ŗĶøßÓŚÉś³ÉĪļµÄ×ܼüÄÜÖ®ŗĶ |
·ÖĪö A£®øł¾ŻĘųĢå±ä³É¹ĢĢå·ÅČČÅŠ¶Ļ£»
B£®ŹÆÄ«ÄÜĮæ±Č½šøÕŹÆŠ”£¬½ĻĪČ¶Ø£»
C£®·“Ó¦·ÅČČ£¬”÷H£¼0£»
D£®ĪüČČ·“Ó¦·“Ó¦ĪļµÄ×ܼüÄÜÖ®ŗĶøßÓŚÉś³ÉĪļµÄ×ܼüÄÜÖ®ŗĶ£®
½ā“š ½ā£ŗA£®¹ĢĢåĮņ±äĪŖĮņÕōĘūŅŖĪüČČ£¬ŌņČ¼ÉÕŹ±·Å³öµÄČČĮæ½ĻÉŁ£¬¹ŹA“ķĪó£»
B£®·“Ó¦ĪŖĪüČČ·“Ó¦£¬ŌņŹÆÄ«ÄÜĮæ±Č½šøÕŹÆŠ”£¬ÄÜĮæŌ½µĶŌ½ĪČ¶Ø£¬¹ŹB“ķĪó£»
C£®ĒāĘųµÄČ¼ÉÕ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĖłŅŌĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ2H2 £Øg£©+O2£Øg£©ØT2H2O£Ø1£©”÷H=-285.8 kJ•mol£¬¹ŹC“ķĪó£»
D£®ĒāŃõ»Æ±µ¾§ĢåÓėĀČ»Æļ§¾§Ģå»ģŗĻĪüČČ£¬ĪüČČ·“Ó¦·“Ó¦ĪļµÄ×ܼüÄÜÖ®ŗĶøßÓŚÉś³ÉĪļµÄ×ܼüÄÜÖ®ŗĶ£¬¹ŹDÕżČ·£®
¹ŹŃ”D£®
µćĘĄ ±¾Ģā漲鷓ӦČČÓėģŹ±ä£¬×ŪŗĻæ¼²éѧɜ¶Ō»Æѧ·“Ó¦ÓėÄÜĮæ±ä»ÆµÄĄķ½ā£¬ĪŖøßæ¼³£¼ūĢāŠĶ£¬×¢ŅāĻą¹Ų»ł“”ÖŖŹ¶µÄ»żĄŪ£¬×¢Ņā°ŃĪÕĪŹĢāµÄ½Ē¶Č£¬Ąķ½āĪļÖŹµÄ¾Ū¼ÆדĢ¬ÓėÄÜĮæµÄ¹ŲĻµ”¢ĪČ¶ØµÄ“óŠ”±Č½ĻµČĪŹĢā£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬11.2 L SO3Ėłŗ¬µÄ·Ö×ÓŹżĪŖ0.5 NA | |
| B£® | 12 gŹÆÄ«ŗĶC60µÄ»ģŗĻĪļÖŠÖŹ×Ó×ÜŹżŅ»¶ØĪŖ6NAøö | |
| C£® | ŌŚČŪȌדĢ¬ĻĀ£¬l mol NaHSO4ĶźČ«µēĄė³öµÄŃōĄė×ÓŹżÄæĪŖ2NA | |
| D£® | ĒāŃõČ¼ĮĻµē³ŲÕż¼«ĻūŗÄ22.4L£Ø±ź×¼×“æö£©ĘųĢåŹ±£¬µēĀ·ÖŠĶعżµÄµē×ÓŹżÄæĪŖ2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 101kPaŹ±£¬H2£Øg£©+1/2O2£Øg£©ØTH2O£Øg£©”÷H=-248kJ•mol-1£¬H2µÄČ¼ÉÕČČĪŖ248kJ•mol-1 | |
| B£® | ĄūÓĆøĒĖ¹¶ØĀÉæÉŅŌ¼ĘĖćÄŃŅŌ²āĮæµÄ·“Ó¦ČČ | |
| C£® | H+£Øaq£©+OH-£Øaq£©ØTH2O£Øl£©”÷H=-57.3 kJ•mol-1£¬ŗ¬1 mol NaOHµÄĒāŃõ»ÆÄʵÄČÜŅŗÓėŗ¬0.5 mol H2SO4µÄÅØĮņĖį»ģŗĻŗó·Å³ö57.3 kJµÄČČĮæ | |
| D£® | ĻąĶ¬Ģõ¼žĻĀ£¬Čē¹ū1 mol HŌ×ÓĖł¾ßÓŠµÄÄÜĮæĪŖE1£¬1 mol H2Ėł¾ßÓŠÄÜĮæĪŖE2£¬Ōņ2E1=E2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
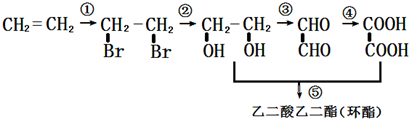
 £»
£» +H2O£¬£»
+H2O£¬£» £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 ĀČĖ®¾ßÓŠ¶ąÖÖŠŌÖŹ£¬øł¾ŻŠĀÖĘĀČĖ®·Ö±šÓėČēĶ¼ĪåÖÖĪļÖŹ·¢ÉśµÄ·“Ó¦ĢīæÕ£ØĀČĖ®×ćĮ棩£ŗ
ĀČĖ®¾ßÓŠ¶ąÖÖŠŌÖŹ£¬øł¾ŻŠĀÖĘĀČĖ®·Ö±šÓėČēĶ¼ĪåÖÖĪļÖŹ·¢ÉśµÄ·“Ó¦ĢīæÕ£ØĀČĖ®×ćĮ棩£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | ŹµŃéÄŚČŻ | ĻÖĻó»ņ½įĀŪ |
| A | Ļņ2SO2+O2?2SO3µÄĘ½ŗāĢåĻµÖŠ¼ÓČėÓÉ18O¹¹³ÉµÄŃõĘų | ŌņSO2ÖŠµÄ18OµÄŗ¬Įæ»įŌö¼Ó |
| B | ŅŌŹÆÄ«ĪŖµē¼«£¬µē½āKIČÜŅŗ£ØĘäÖŠŗ¬ÓŠÉŁĮæ·ÓĢŖ£© | Ņõ¼«ŅŻ³öĘųĢåĒŅø½½üČÜŅŗ³ŹĻÖŗģÉ« |
| C | FeCl3+3KSCN?Fe£ØSCN£©3+3KCl Ę½ŗāĢåĻµÖŠ¼ÓČėÉŁĮæKSCN¹ĢĢ壬ČÜŅŗŃÕÉ«¼ÓÉī | ŗćĪĀŹ±Ōö“ó·“Ó¦ĪļÅØ¶Č£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ |
| D | ĻņpH=1µÄŃĪĖįŗĶ“×Ėįø÷0.5LµÄČÜŅŗÖŠø÷¼ÓČė1.4gĢś·Ū | “×ĖįÖŠÉś³ÉH2µÄĖŁĀŹæģĒŅ×īÖÕĘųĢåĮæ¶ą |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
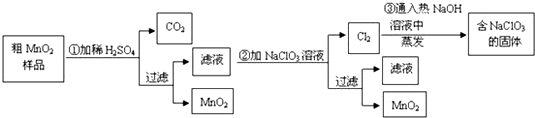
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com