
����Ŀ������A��B��C��D���ֻ��������ɫ��Ӧ�Ļ����Ϊ��ɫ������C��һ�ֵ���ɫ���壬���ȹ���A������D��ͬʱ�õ���ʹ����ʯ��ˮ����ǵ���ɫ���塣A��B��Һ��Ϻ�ɵõ�D��
��1��д���������ʵĻ�ѧʽ��A��_______��B��_______��C��_______��D��_______��
��2��д��A��B��Ӧ�����ӷ���ʽ��_________________________________________��
��3���ڼס��ҡ��������ĸ��ձ��и�����100 mLˮ���ٷֱ����0.1 mol ���������ʣ����ơ��������ơ��۹������ơ����������ƣ�������ȫ�ܽ���ĸ��ձ������ʵ����������ɴ�С��˳���ǣ����ţ�___________________��
���𰸡� NaHCO3 NaOH Na2O2 Na2CO3 HCO3��+ OH��==CO32��+H2O ��=��>��>��
������������A��B��C��D���ֻ��������ɫ��Ӧ�Ļ����Ϊ��ɫ����˾�������Ԫ�ء�����C��һ�ֵ���ɫ���壬C�ǹ������ơ����ȹ���A������D��ͬʱ�õ���ʹ����ʯ��ˮ����ǵ���ɫ������A��B��Һ��Ϻ�ɵõ�D������A��̼�����ƣ�D��̼���ƣ�B���������ơ���
��1���������Ϸ�����֪A��D�������ʵĻ�ѧʽ�ֱ���NaHCO3��NaOH��Na2O2��Na2CO3����2��A��B��Ӧ�����ӷ���ʽΪHCO3��+OH��==CO32��+H2O����3���ơ������ơ��������ƺ�ˮ��Ӧ�ķ���ʽ�ֱ����£�
Na+H2O=NaOH+1/2H2������Һ���ӵ�����=m��Na��-m��H2��=2.3g-0.1g=2.2g��
Na2O+H2O=2NaOH����Һ���ӵ�����=m��Na2O��=0.1mol��62g/mol=6.2g��
Na2O2+H2O=2NaOH+1/2O2������Һ���ӵ�����=m��Na2O2��-m��O2��=m��Na2O��=6.2g��
���������Ƽ���ˮ�У���Һ���ӵ�����Ϊ�������Ƶ�����=0.1mol��40g/mol=4g��������Һ���ӵ�������С˳��Ϊ���ƣ��������ƣ�������=�������ƣ�������ԭ���غ�֪��0.1mol���ơ������ơ��������ơ�������������ˮ�����������Ƶ����ʵ����ֱ�Ϊ��0.1mol��0.2mol��0.2mol��0.1mol��ͨ�����Ϸ�����֪��0.1mol���ơ������ơ��������ơ��������Ʒֱ�����ˮ������Һ�����������ֱ�Ϊ�� ![]() �����Թ�����ȫ�ܽ���ĸ��ձ������ʵ����������ɴ�С��˳���Ǣ�=��>��>�ܡ�
�����Թ�����ȫ�ܽ���ĸ��ձ������ʵ����������ɴ�С��˳���Ǣ�=��>��>�ܡ�


 ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������к��й��ۼ������ӻ������ǣ� ��
A. Ba��OH��2B. H2OC. HClD. CaCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ɷ������·�Ӧ��P4+5O2�TP4O10 �� ��֪�������л�ѧ����Ҫ���յ������ֱ�Ϊ��P��P��a kJmol��1��P��O��b kJmol��1��P=O��c kJmol��1��O=O��d kJmol��1 �� ����ͼʾ�ķ��ӽṹ���й����ݹ���÷�Ӧ�ġ�H��������ȷ���ǣ� �� 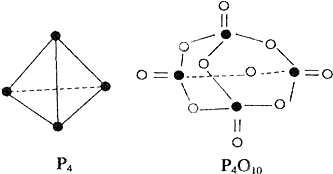
A.��6a+5d��4c��12b��kJmol��1
B.��4c+12b��6a��5d��kJmol��1
C.��4c+12b��4a��5d��kJmol��1
D.��4a+5d��4c��12b��kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˹�м���������������Ϊ1:2ʱ��ը�����������ʱ������������������Ϊ
A. 1:2 B. 1:4 C. 1:1 D. 2:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA��g��+B��g��C��g��+D��g�������е������仯��ͼ��ʾ���ش��������⣮
��1���÷�Ӧ����Ӧ������ȡ��������ȡ�����
��2������Ӧ�ﵽƽ��ʱ�������¶ȣ�A��ת���� �����������С���������䡱����ԭ����
��3����Ӧ��ϵ�м�������Է�Ӧ���Ƿ���Ӱ�죿����С������ޡ�����ԭ���� ��
��4���ڷ�Ӧ��ϵ�м����������Ӧ��������E1��E2�ı仯�ǣ�E1 �� E2�����������С���������䡱���� 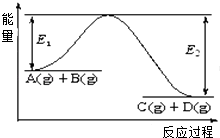
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3.9�˵�þ���Ͻ�Ͷ�뵽500mL 2mol/L�������У�������ȫ�ܽ⣬�ټ���4mol/L������������Һ����Ҫ���ɳ�����࣬������������������Һ�������()
A��125mL B��200mL C��250mL D��560mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� �� 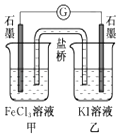
A.��������������ʴʱ������ʴ�����ʺ�����Ũ����
B.��״���£�2.24LCCl4�����й��ۼ�����ĿΪ0.4��6.02��1023
C.�����ʺϵ�����������Ӧ2Fe3++2I���T2Fe2++I2��Ƴ���ͼ��ʾ��ԭ��أ�������֭����Ϊ����ڼ�������FeCl2���壬������ʯī�缫Ϊ����
D.��ʢ��2mL����H2S��Һ����֧�Թ��зֱ�μ�1��Ũ�Ⱦ�Ϊ0.1mol/L��ZnSO4��Һ��CuSO4��Һ����CuS���ɶ���ZnS���ɣ���Ksp��CuS����Ksp��ZnS��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Ϊ������Ԫ�أ�������Ԫ�����ڱ��е�λ������ͼ��ʾ����Yԭ�ӵ������������Ǵ�����������2��������˵������ȷ���ǣ� �� ![]()
A.�⻯���ȶ��ԣ�X��Y
B.����������Ӧ��ˮ��������ԣ�W��Y
C.4��Ԫ�صĵ����У�W���ʵ��ۡ��е����
D.�����W���ʾ���Ư����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����1���õ�����CuSO4��5H2O������0.200mol/L CuSO4��Һ240mL������Ҫ�IJ�������Ϊ���ձ�����Ͳ��________________________��Ҫ��ȫ����Ӧ��ȡ����������Ϊ____________��
��2�����в���ʹ����CuSO4��ҺŨ��ƫ�͵���____________��
A���۲�̶���ʱ����
B���۲�̶���ʱ����
C�����ݺ�ת����ƿ���Σ�����Һ����͵���ڱ��ߣ��ٲ�����ˮ������
D��������Һǰ������ƿ������������ˮ
��������1���õ����ű���÷�Ӧ�ĵ���ת�Ʒ������Ŀ�����ش�������⣺
KClO4+8HCl(Ũ)=KCl+4Cl2��+4H2O____________���������뻹ԭ�������ʵ���֮��Ϊ____________��
��2����ƽ��ѧ����ʽ������ѧ���������ڿհ״���
_____KMnO4+___FeSO4+___H2SO4=___K2SO4+__MnSO4+__Fe2(SO4)3+__H2O
���������뻹ԭ��������ʵ�����Ϊ________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com