
����Ŀ����������ĵ���ƽ�ⳣ�����±���
���� | HCOOH | HCN | H2CO3 |
����ƽ�ⳣ�� (25 |
|
|
|
����ѡ��������( )
A.CN + H2O + CO2 �� HCN +HCO3��
B.2HCOOH + CO32�� �� 2HCOO + H2O + CO2��
C.�к͵��������pH��HCOOH��HCN����NaOH����ǰ�ߴ��ں���
D.���������Ũ�ȵ�HCOONa��NaCN��Һ��������������ǰ��С�ں���
���𰸡�CD
��������
����ĵ���ƽ�ⳣ��Խ��������Խǿ����pH��������Һ������Խǿ���������ʵ���Ũ��ԽС�����������ˮ��̶�ԽС�����ǿ���ܺ������η�Ӧ��ȡ����������
A����ĵ���ƽ�ⳣ��Խ���������Խǿ��ǿ���ܹ���ȡ���ᣬ���Զ��߷�Ӧ����HCN��HCO3�����ӷ���ʽΪCN+H2O+CO2�THCN+HCO3����A��ȷ��
B������ǿ��˳����HCOOH>H2CO3>HCN>HCO3��ǿ���ܺ������η�Ӧ�������ᣬ���Է�Ӧ����ʽΪ2HCOOH + CO32�� = 2HCOO + H2O + CO2������B��ȷ��
C����pH���������HCOOH��HCN��n(HCN)>n(HCOOH)���к�����Ҫ������ʵ�����������ʵ��������Ԫ�������ȣ������к͵��������pH��HCOOH��HCN����NaOH����ǰ��С�ں��ߣ���C����
D�����ݵ���غ㣬c(HCOO)+c(OH)=c(Na+)+c(H+)��c(CN)+c(OH)=c(Na+)+c(H+)��������������n(Na+)+n(H+)��2������NaCN��ˮ��̶ȴ�NaCN��Һ�е�c(OH)��c(H+)С��c(Na+)��ͬ�����Լ�����������Ũ�ȴ�D����
��ѡCD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ���Ũ�ȵ�Na2S��NaOH�����Һ�еμ�ϡ������������������Ҫ��������֣�H2S��HS����S2�����ķֲ�������ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ�������μ���������Ĺ�ϵ����ͼ��ʾ�����Եμӹ���H2S������ݳ�����
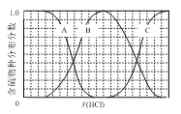
(1)��������B��ʾ__________�������ӷ��ţ���
(2)�ڵμ���������У���Һ��c(Na+)�뺬�������Ũ�ȵĴ�С��ϵΪ_____________(��ѡ��ĸ)��
a��c(Na+)= c(H2S)+c(HS��)+2c(S2��)
b��2c(Na+)=c(H2S)+c(HS��)+c(S2��)
c��c(Na+)=3[c(H2S)+c(HS��)+c(S2��)]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ȽϷǽ�����ǿ����C_____Cl�������������������=������һ����ѧ����ʽ˵����________��
��2��Mg2C3���Ժ�ˮ�������ɱ�Ȳ����д��Mg2C3�ĵ���ʽ________��
��3����������۵��һ����Ӿ���ߣ�����ԭ�����������_______������ʾ���Ӱ�����Ļ�ѧ�������֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ȳ����������ȷ����
A.1 mol��Ȳ�������2 mol Cl2�����ӳɷ�Ӧ
B.��ϩ����Ȳ�ĺ�̼����
C.��ͬ��������Ȳ�ͼ�����ȫȼ�պ�����ˮ��������ͬ
D.Ȳ����ϩ�������ڲ��������������ʾ���һ���������ԣ��綼����ʹ��ˮ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ���ǣ�
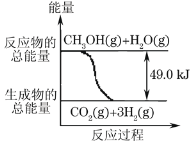
��CH3OH(g)+H2O(g)��CO2(g)+3H2(g) -49.0kJ
��CH3OH(g)+![]() O2(g)��CO2(g)+2H2(g)+192.9kJ
O2(g)��CO2(g)+2H2(g)+192.9kJ
����˵����ȷ����( )
A.1molCH3OH��ȫȼ�շ���192.9kJ
B.��Ӧ���е������仯��ͼ��ʾ
C.CH3OHת���H2�Ĺ���һ��Ҫ��������
D.���ݢ���֪��Ӧ��CH3OH(l)+![]() O2(g)��CO2(g)+2H2(g)+Q��Q<192.9kJ
O2(g)��CO2(g)+2H2(g)+Q��Q<192.9kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��ԭ�ӵĵ����Ų�ʽΪ![]() ������ԭ�Ӻ�������Ų���Ԫ����Ԫ�����ڱ��е�λ�ù�ϵ��������и��⣺
������ԭ�Ӻ�������Ų���Ԫ����Ԫ�����ڱ��е�λ�ù�ϵ��������и��⣺
(1)��Ԫ�ش���Ԫ�����ڱ��ĵ�______���ڣ������ڵ�Ԫ��������______��
(2)��Ԫ�ش���Ԫ�����ڱ��ĵ�______�壬����ķǽ���Ԫ��������______��
(3)���Ʋ��Ԫ�ش���Ԫ�����ڱ���______���������������������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(MoS2�� ����Mo�Ļ��ϼ�Ϊ+4)����Ϊ��������֮���������õ�Ʒ�ʵĻ����(��MoS2��SiO2 �Լ�CuFeS2������)�Ʊ��ߴ��������һ�������������£�

�ش��������⣺
(1)��������м����������Ϊ�˳�ȥ����SiO2���÷�Ӧ�Ļ�ѧ����ʽΪ___________��
(2)����������������������Ҫ�ǽ�MoS2ת��ΪMoO3���ڸ÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ________��
(3)���������ղ�������ս���������������ǰ������з��鴦������Ŀ����_________����������������( NH4)2 MoO4��Ӧ�Ļ�ѧ����ʽΪ___________��
(4)���������������Һ�м���Na2S�������ת��Ϊ��������[(NH4)2MoS4]�����������(NH4)2 MoS4�����ᷴӦ����MoS3������������Ӧ�����ӷ���ʽΪ_________________��
(5)�ߴ�MoS2����Ȼ����ڼ����ķ����Ⱦ���MoS2.8�����ʣ��ڸ�������Ϊ���ֵ����ԣ�MoԪ����+4��+6���ּ�̬����MoS2��Mo4+��ռMoԪ�ص����ʵ������� Ϊ__________��
Ϊ__________��
(6)�����ƾ���( Na2 MoO4 2H2O)��һ����������ȴˮϵͳ������ʴ����������MoS2�Ʊ������Ʊ������������Ba(OH)2�����ȥSO42-������Һ��c(MoO42-)=0.4 mol/L��c(SO42-)=0. 05 mol/L�������£���BaMoO4������ʼ����ʱ��SO42-��ȥ����Ϊ____________ [������Һ����仯����֪��259�棬Ksp( BaMoO4)=4.0��10-8 �� Ksp(BaSO4)=1.1��10-10]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ�е������DZ�ʾ��������һ��ʱ��2NO(g)+O2(g)2NO2(g) ��H��0��Ӧ��NO��ת�������¶ȵĹ�ϵ���ߣ�ͼ�б���a��b��c��d�ĵ㣬���б�ʾδ�ﵽƽ��״̬����v����v���ĵ��ǣ� ��

A.a��
B.b��
C.c��
D.d��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�2H2(g)+O2(g)![]() 2H2O(l)+566kJ������˵���������
2H2O(l)+566kJ������˵���������
A.H2![]() H+H�Ĺ�����Ҫ����
H+H�Ĺ�����Ҫ����
B.������2molˮ��������ų�����������566kJ
C.2g������ȫȼ������Һ̬ˮ���ͷŵ�����Ϊ283kJ
D.2mol������1mol����������֮�ʹ���2molҺ̬ˮ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com