
| A. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| B. | 常温常压下,5.6g乙烯(C2H4)与丁烯(C4H8)的混合物中含有的氢原子的数目为0.8NA | |
| C. | 在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA | |
| D. | 1mol Fe与足量的稀硫酸反应转化为Fe3+失去的电子数为3NA |
分析 A.标况下苯为液体;
B.乙烯和丁烯的最简式为CH2,根据最简式计算出混合物中含有氢原子数目;
C.46%的乙醇水溶液中,乙醇含有氢原子,而水也含有氢原子;
D.每1mol铁与足量的稀硫酸反应失去电子数为2NA个.
解答 解:A.标况下苯为液体,不能使用气体摩尔体积,故A错误;
B.乙烯和丙烯的最简式为CH2,5.6g混合气体含有0.4mol最简式CH2,含有0.8mol氢原子,含有氢原子的数目为0.8NA,故B正确;
C.46%的乙醇水溶液中,乙醇含有氢原子,而水也含有氢原子,故含有的氢原子总数大于3NA,故C错误;
D.每1mol铁与足量的稀硫酸反应失去电子数为2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的应用,氧化还原反应电子转移的计算等,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 放热反应不需要加热就能发生 | |
| B. | 升高温度或加入催化剂,均可以改变化学反应的反应热 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| D. | 一定条件下某吸热反应能自发进行,说明该反应是熵增大的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
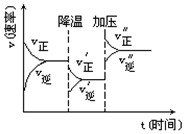 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 降温后逆反应速率增大 | B. | 逆反应是放热反应 | ||
| C. | A、B、C、D均为气体 | D. | 若A、B是气体,则D是液体或固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 马口铁(镀锡铁)镀层破损铁的腐蚀速率加快 | |
| B. | 为了防止钢铁设备腐蚀,利用外加电流的阴极保护法,应另附加一惰性电极,惰性电极作阴极 | |
| C. | 可以采用改变金属组成或结构的方法防止金属腐蚀 | |
| D. | 为保护海轮的船壳,利用牺牲阳极的阴极保护法,常在船壳上镶入锌块 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④ | C. | ④ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| c(H2S)/mol/L | 1.00 | 0.80 | 0.62 | 0.48 | 0.40 | 0.40 |
| c(SO2)/mol/L | 1.00 | 0.90 | 0.81 | 0.74 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A. | 氯化银、溴化银和碘化银的溶解度依次增大 | |
| B. | 将硫酸银溶解于水后,向其中加入少量硫化钠固体,不能得到黑色沉淀 | |
| C. | 在5mL1.5×10-5 mol•L-1的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3mol•L-1的AgNO3溶液,不能观察到白色沉淀 | |
| D. | 在烧杯中放入6.24 g 硫酸银固体,加200 g 水,经充分溶解后,所得饱和溶液的体积为200 mL,溶液中Ag+ 的物质的量浓度为0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:
南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com