
分析 (1)由质量守恒定律可知反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+A↑+2H2O中,A为SO2,是酸性氧化物,可导致酸雨,具有还原性,能被酸性KMnO4溶液氧化,则氧化剂为高锰酸钾;
(2)二氧化硫检验漂白性,能够使品红溶液褪色;淡黄色沉淀为S单质,说明二氧化硫在反应中被还原,表现了氧化性;双氧水具有氧化性,二氧化硫具有还原性,二者能够发生氧化还原反应生成硫酸;
(3)根据反应方程式计算出转移0.2mol电子生成二氧化硫的物质的量,再计算出标况下二氧化硫的体积;氢氧化钠溶液与二氧化硫反应生成亚硫酸钠和水,根据二氧化硫的物质的量及反应方程式计算出消耗氢氧化钠的物质的量,再根据V=$\frac{n}{c}$计算出氢氧化钠溶液的体积.
解答 解:(1)A物质可以导致酸雨的形成,则A是二氧化硫,属于酸性氧化物,A物质可以使酸性KMnO4溶液褪色,此反应中SO2失去电子,氧化剂是KMnO4,
故答案为:d;SO2;KMnO4;
(2)A为二氧化硫,会观察到溶液褪色,说明二氧化硫具有漂白性,能够漂白品红溶液;若将二氧化硫通入Na2S溶液,观察到溶液中出现淡黄色浑浊,淡黄色为单质硫,二氧化硫中S的化合价为+4价,反应变成了0价,二氧化硫的化合价降低被还原,说明二氧化硫具有氧化性;双氧水具有强氧化性,能够将二氧化硫氧化成硫酸,
故答案为:c;a;H2SO4;
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,由反应方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知,1mol铜完全反应转移了2mol电子,会生成1molSO2气体,则该反应过程中转移了0.2mol电子,生成了0.1molSO2气体,在标准状况下体积为22.4L/mol×0.1mol=2.24L;氢氧化钠溶液与二氧化硫反应的化学方程式为2NaOH+SO2=Na2SO3+H2O,根据反应可知,0.1mol二氧化硫完全反应消耗氢氧化钠的物质的量为0.2mol,消耗4mol•L-1的NaOH溶液的体积为:$\frac{0.2mol}{4mol/L}$=0.05L,
故答案为:2.24;2NaOH+SO2=Na2SO3+H2O;0.05.
点评 本题考查了浓硫酸的性质、常见气体的检验方法及物质的量的计算,题目难度中等,注意掌握浓硫酸的化学性质、二氧化硫的性质及检验方法,明确物质的量在化学方程式计算中的应用.


科目:高中化学 来源: 题型:选择题
| A. | 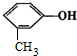 与 与 | B. | CH3-CH=CH2与 | ||
| C. | CH3-O-CH3和CH3CH2OH | D. | 正戊烷和异戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应的反应物总能量,高于生成物的总能量 | |
| B. | 需加热或点燃才发生的反应必为吸热反应 | |
| C. | 酸与碱的中和反应是放热反应 | |
| D. | 焦炭在高温下与水蒸气的反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:HI>HBr>HCl>HF | |
| B. | 稳定性:NH3>PH3>AsH3(As与N位于同一主族) | |
| C. | 酸性:HClO4>H2SO4>H3PO4 | |
| D. | 碱性:NaOH>Mg(OH)2>Be(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
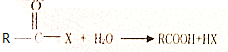
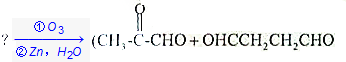

 .
.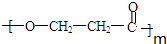 +(m-1)H2O.②B-C、C-E的反应类型分别为:加成反应、缩聚反应.
+(m-1)H2O.②B-C、C-E的反应类型分别为:加成反应、缩聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O比Na2O2稳定 | B. | 均可与水反应生成氧气 | ||
| C. | 均可与CO2反应 | D. | 均是典型的碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逐渐减小 | B. | 逐渐增大 | ||
| C. | 先逐渐增大,后逐渐减小 | D. | 先逐渐减小,后逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的0.1 mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | NaHSO3和NaHCO3两溶液混合呈中性的溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+c(RO32-) | |
| C. | 常温下,等物质的量浓度的三种溶液:①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2中c(NH4+):①<③<② | |
| D. | 常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:3 | B. | 2:3 | C. | 1:4 | D. | 2:7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com