
| 元素 | Mn | Fe | |
| 电离能 | I1 | 717 | 759 |
| (kJ•mol-1) | I2 | 1 509 | 1 561 |
| I3 | 3 248 | 2 957 | |
分析 (1)Mn2+的3d轨道上有5个电子,由题中信息知[Mn(H2O)6]2+有颜色;
(2)A.根据化合价代数和为0计算;
B.Fe原子核外电子数为26,根据能量最低原理书写;
C.硫酸亚铁中铁元素的化合价是+2价,[Fe2(OH)n(SO4)3-n/2]m中铁元素的化合价是+3价,铁离子水解生成氢氧化铁,所以由FeSO4溶液制PFS需经过氧化、水解和聚合的过程;
D.电离能越大,其失电子越难;
(3)①该化合物中存在配位键、共价键、离子键;
②形成单键时,C原子以sp3形式杂化;形成双键时,C原子以sp2形式杂化;
③等电子体是具有相同的价电子数和原子数的分子或离子;
④基态铬原子的最外层电子排布是4s1,同周期中最外层电子数与铬原子相同的元素有K、Cu.
解答 解:(1)Mn2+的外围电子排布为d5,3d轨道上有5个电子,由题中信息知[Mn(H2O)6]2+有颜色,
故答案为:有;
(2)A.设[Fe2(OH)n(SO4)3-n/2]m中Fe元素化合价为x,根据化合价代数和为0,可知2x-n+(3-$\frac{n}{2}$)×(-2)=0,解得x=+3,故A正确;
B.Fe原子核外电子数为26,铁元素的价电子数8,且4s轨道排2个电子,3d轨道排6个电子,所以铁原子的价电子排布式是3d64s2,故B正确;
C.硫酸亚铁中铁元素的化合价是+2价,[Fe2(OH)n(SO4)3-n/2]m中铁元素的化合价是+3价,铁离子水解生成氢氧化铁,所以由FeSO4溶液制PFS需经过氧化、水解和聚合的过程,故C正确;
D.Fe2+再失去一个电子需要的能量比气态Mn2+再失去一个电子需要能量小,所以气态Fe2+再失去一个电子比气态Mn2+再失去一个电子容易,故D错误;
故选:D;
(3)①该化合物中,Cr3+与O原子之间形成配位键,配体中其它原子之间形成共价键,配离子与外界氯离子之间形成离子键,故答案为:配位键、共价键、离子键;
3d轨道上有5个电子,
②C原子形成单键时,形成4个σ键,杂化轨道数目为4,C原子以sp3形式杂化;C原子形成双键时,形成4个σ键,C原子中轨道数目为3,C原子以sp2形式杂化,
故答案为:sp3和sp2;
③等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是:H2S等,
故答案为:H2S等;
④基态铬原子的最外层电子排布是4s1,同周期中最外层电子数与铬原子相同的元素有K、Cu,
故答案为:K、Cu.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、化学键、等电子体等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列关于化学能转化为电能的四种装置的说法正确的是




电池Ⅰ 电池Ⅱ 电池Ⅲ 电池Ⅳ
A.电池Ⅰ中锌是正极
B.电池Ⅱ是一次电池
C.电池Ⅲ工作时,氢气发生还原反应
D.电池Ⅳ工作时,电子由锌通过导线流向碳棒
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙提高相同温度 | B. | 甲中加入1molHe,乙不变 | ||
| C. | 甲降低温度,乙不变 | D. | 甲增加1molH2,乙增加1molI2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
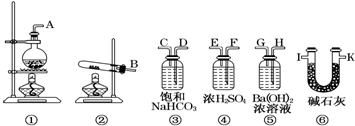
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
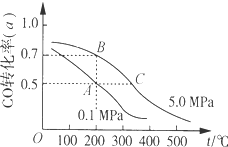
| A. | A、B两点表示在某时刻达到平衡状态,此时A、B两点时容器中,n(A)总:n(B)总=4:5 | |
| B. | 在A点时保持恒温恒容,再向体系中充入少量He,重新达到平衡前v(正)>v(逆) | |
| C. | 若开始时向容器中充入1mol CO与2mol H2,达到平衡(与A点相同温度压强)时,CO的 转化率小于50% | |
| D. | 在不改变反应物用量的情况下,降温、加压、将甲醇从混合体系中分离出来均可提高CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ①②③⑤ | C. | ①③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应一定是氧化还原反应 | B. | 非金属氧化物一定是酸性氧化物 | ||
| C. | 金属氧化物一定是碱性氧化物 | D. | 碱性氧化物一定是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
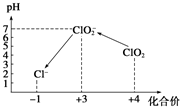 Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com