
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol?L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |


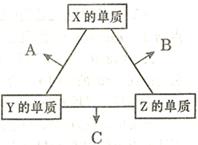
科目:高中化学 来源:不详 题型:填空题
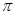 键的数目为 。
键的数目为 。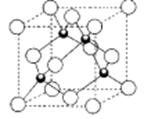
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素Y的最高化合价为+7 |
| B.三种元素的原子半径rZ>rY>rX |
| C.Z的单质比Y的单质更易与H2反应 |
| D.化合物X2Z2中阴阳离子数之比为1: 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
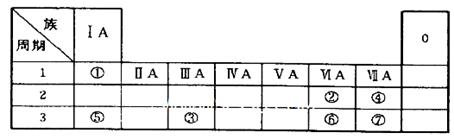
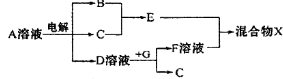
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
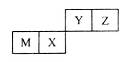
| A.Y元素气态氢化物的稳定性大于Z元素的 |
| B.M和Y两种元素,可以形成电子层结构相同的两种简单离子 |
| C.X元素最高价氧化物对应水化物的酸性弱于Y元素的 |
| D.M元素的氧化物既可以与酸溶液反应,也可以与碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同主族元素从上到下,单质的熔点逐渐降低 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.第IA族元素铯的两种同位素137Cs比133Cs多4个质子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.10Be和9Be是中子数不同质子数相同的不同原子 |
| B.10Be的原子核内中子数比质子数多 |
| C.5.2 g26Al3+中所含的电子数约为1.2×1024 |
| D.26Al和26Mg的质子数、中子数和核外电子数都不相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 |
| B.若X和Y处于不同的周期,则M溶于水所得溶液肯定呈碱性 |
| C.若M属于离子化合物,则该化合物中只存在离子键 |
| D.若M属于离子化台物,则该化合物中原子个数比可能为1:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

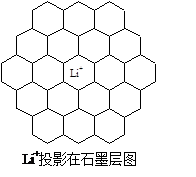
| | BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 分解温度 | 100℃ | 540℃ | 960℃ | 1289℃ | 1360℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com