
【题目】元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体的晶胞结构如图所示。

(1)该晶体的阳离子与阴离子个数比为____。
(2)该晶体中Xn+中n=____。
(3)X元素的原子序数是_____。
(4)晶体中每个N3-被____个等距离的Xn+包围。
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】某活动小组利用废铁屑(含少量S等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4 ·6H2O](M=392g/mol),设计如图所示装置(夹持仪器略去)。
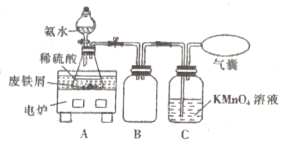
称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50 ~60°C热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)在实验中选择50~60℃热水浴的原因是___________________。
(2)装置B的作用是_______________________________。
(3)检验制得的(NH4)2SO4·FeSO4·6H2O中是否含有Fe3+的方法:将硫酸亚铁铵晶体用加热煮沸过的蒸馏水溶解,然后滴加________________(填化学式)。
(4)产品中杂质Fe3+的定量
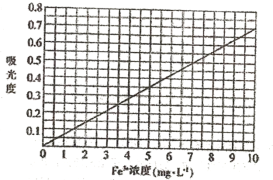
①配制Fe3+浓度为0.1 mg/mL的标准溶液100mL。称取________(精确到0.1)mg高纯度的硫酸铁铵[(NH4)Fe(SO4)2·12H2O],加入20.00 mL经处理的去离子水。振荡溶解后,加入2 mol·L-1HBr溶液1mL和1mol·L-1KSCN溶液0.5mL,加水配成100mL溶液。
②将上述溶液稀释成浓度分别为0.2、1.0、 3.0、5.0、 7.0、 10.0(单位: mg·L-1)的溶液。分别测定不同浓度溶液对光的吸收程度(吸光度),并将测定结果绘制成如图所示曲线。取硫酸亚铁铵产品,按步骤①配得产品硫酸亚铁铵溶液10mL,稀释至100mL,然后测定稀释后溶液的吸光度,两次测得的吸光度分别为0.590、0.610,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为_______mg·L-1。
(5)称取mg产品,将产品用加热煮沸的蒸馏水溶解,配成250mL溶液,取出100mL放入锥形瓶中,用c mol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为___________(用含c、V、m的代数式表示,化简)。滴定时,下列滴定方式中,最合理的是___________(填字母)。
A. 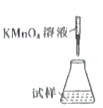 B.
B. 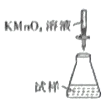 C.
C. 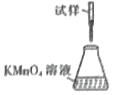
若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,实验结果将会_________(填“偏大”“偏小”或“无影响”。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 为直线形结构,
为直线形结构,![]() 为平面正三角形结构,
为平面正三角形结构,![]() 为三角锥形结构,请推测COS、
为三角锥形结构,请推测COS、![]() 、
、![]() 的空间构型:______________________________。
的空间构型:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下物质:①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]() 、⑤
、⑤![]() 、⑥
、⑥![]() 、⑦
、⑦![]() 、⑧
、⑧![]() 和⑨
和⑨![]() 。
。
(1)只含有![]() 键的是__________(填序号,下同);
键的是__________(填序号,下同);
(2)既含有![]() 键又含有
键又含有![]() 键的是__________。
键的是__________。
(3)含有由两个原子的![]() 轨道重叠形成
轨道重叠形成![]() 键的是__________。
键的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。它是一种体心立方结构。实验测得金属钨的密度为19.30g·cm-3,钨的相对原子质量为183.9.假定金属钨为等直径的刚性球,请回答以下各题:
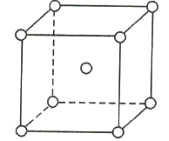
(1)每一个晶胞中分摊到__________个钨原子。
(2)计算晶胞的边长a。_____________
(3)计算钨的原子半径r(提示:只有体对角线上的各个球才是彼此接触的)。___________
(4)计算金属钨原子采取的体心立方密堆积的空间利用率。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1.00L浓度均为0.0100mol/L的Na2SO3、NaOH 混合溶液中通入HCl气体调节溶液pH(忽略溶液体积变化)。其中比H2SO3、HSO3-、SO32-平衡时的分布系数(各含硫物种的浓度与含硫物种总浓度的比)随HCl气体体积(标况下)的变化关系如图所示(忽略SO2气体的逸出);已知Ka1代表H2SO3在该实验条件下的一级电离常数。下列说法正确的是
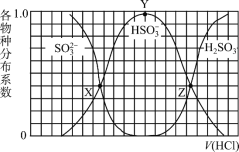
A.Z点处的pH=-lgKa1(H2SO3)
B.从X点到Y点发生的主要反应为SO32- +H2OHSO3- +OH-
C.当V(HCl)≥672mL时,c(HSO3-) = c(SO32-)=0mol/L
D.若将HCl改为NO2,Y点对应位置不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为NaCl和CsCl的晶体结构,下列说法错误的是( )
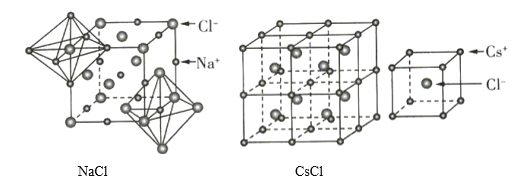
A.NaCl和CsCl都属于AB型的离子晶体
B.NaCl和CsC1晶体中阴、阳离子个数比相同,所以二者的阴、阳离子的配位数也相同
C.CsCl晶体中阴、阳离子的配位数均为8
D.NaCl和CsCl都属于AB型的离子晶体,但阴、阳离子的半径比不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。

(1)反应后观察到A中反应液微沸,有红棕色气体充满A容器,写出A中反应的化学方程式__;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__;
(3)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入__溶液,若产生淡黄色沉淀,则能证明。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、Q、E、M、G原子序数依次增大的七种元素,除G元素外其余均为短周期主族元素。X元素原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的价电子排布式为![]() ,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为
,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为![]() 。回答下列问题:
。回答下列问题:
(1)写出第3周期基态原子未成对电子数与G的相同且电负性最大的元素: ___________ (填元素名称)。GQ受热分解生成![]() 和
和![]() ,请从G的原子结构来说明
,请从G的原子结构来说明![]() 受热易分解的原因: ______ 。
受热易分解的原因: ______ 。
(2) Z、Q、M三种元素的第一电离能由大到小的顺序为 _________ (用元素符号表示)。
(3) Y与Q形成原子个数比为1:2的化合物的电子式为 _________ 。
(4) Z、M、E所形成的简单离子的半径由大到小的顺序为 __________ (用离子符号表示)。
(5) X、Y、Z、Q的电负性由大到小的顺序为 _______ (用元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com