
写出除去下列物质中杂质所选用的试剂及发生反应的离子方程式:
(1)盐酸(硫酸),试剂_________,离子方程式__________________________;
(2)NaOH(Na2CO3),试剂________,离子方程式___________ _________ ___;
(3)NaCl(CuCl2),试剂________,离子方程式_______________________ __。
科目:高中化学 来源: 题型:解答题
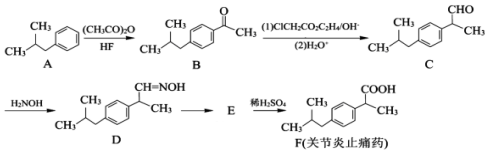
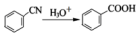 ;②
;② ; ③
; ③ .
.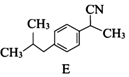 .
.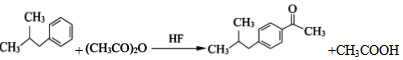 .
.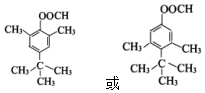 (写一种).
(写一种).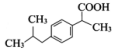 )的一种改良法是以2-甲基-1-丙醇(
)的一种改良法是以2-甲基-1-丙醇(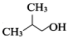 )、苯、
)、苯、 .
.查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:实验题
CoCl2·6H2O是一种饲料营养强化剂。工业上利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
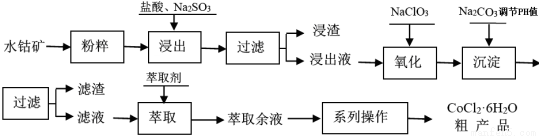
已知:① 浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
② CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
③ 部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01 mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)水钴矿进行预处理时加入Na2SO3,其主要作用是(用化学方程式说明) 。
(2)写出NaClO3在浸出液中发生主要反应的离子方程式 ;若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“系列操作”中包含3个基本实验操作依次是 、 和过滤。
(4)浸出液加Na2CO3调pH至5.2 时,所得滤液中金属离子有 ;萃取液中含有的主要金属阳离子是 。
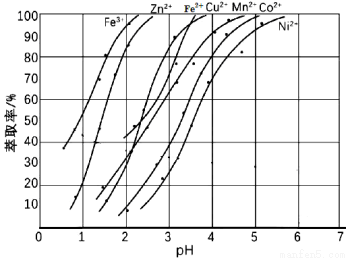
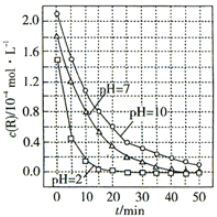
(5)为寻找合适的萃取剂,发现某种萃取剂对部分离子的萃取率与溶液pH 的关系如下图所示。请写出有关萃取规律,并说明本流程是否能用该萃取剂进行萃取。
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和叙述Ⅱ均正确并且有因果关系的是( )
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | S2-具有还原性 | S2-能除去工业废水中的Cu2+等重金属离子 |
B | NH3具有还原性 | 蘸有浓硝酸的玻璃棒靠近浓氨水时冒白烟 |
C | 熔融状态的Al2O3中有自由移动的Al3+和O2- | 电解熔融状态的Al2O3制备Al |
D | SO2具有漂白性 | SO2能使紫色石蕊试液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
中国历史悠久,很早就把化学技术应用到生产生活中。下列与化学有关的说法不正确的是( )
A.闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺
B.四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成
C.侯氏制碱法的工艺过程中应用了物质溶解度的差异
D.由于中国大部分地区都缺碘,而缺碘就会引起碘缺乏病,80年代国家强制给食用的氯化钠食盐中加入碘单质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
人体正常血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化为Fe3+而中毒,服用维生素C可以解毒。对上述事实的分析正确的是
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被氧化
D.亚硝酸盐被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
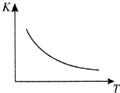 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:| 时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
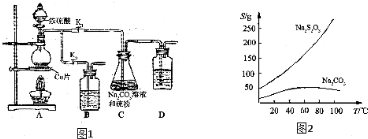
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com