A
分析:A.浓硫酸可以和Zn反应生成SO
2,随着硫酸的消耗和水的生成,硫酸变稀,锌与稀硫酸反应能生成氢气,根据方程式质量、摩尔质量、分子数、阿伏伽德罗常数之间的关系式计算判断;
B.氯气与水反应是可逆反应,71 g氯气通人足量的水中,反应中转移的电子总数小于N
A;
C.标准状况下气体摩尔体积是22.4L/mol,标准状况下,CH
2Cl
2和CHCl
3的混合物为液体,从气体摩尔体积的应用条件分析判断;
D.1个氮原子含有7个电子,1 mol N
2所含的电子数为14N
A.
解答:A.浓硫酸与锌反应的方程式Zn+2H
2SO
4 
ZnSO
4+SO
2↑+2H
2O,从方程式可以看出1mol锌生成1mol二氧化硫气体,随着硫酸的消耗和水的生成,硫酸变稀,这是就会发生锌与稀硫酸反应,Zn+H
2SO
4=ZnSO
4+H
2↑,从方程式可以看出1mol锌生成1mol氢气,所以1mol锌无论与浓硫酸反应还是与稀硫酸反应,生成气体都为1mol,13 g锌的物质的量为n=

=
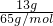
=0.2mol,生成气体分子数为0.2N
A,故A正确;
B.71g氯气物质的量为1mol,氯气通人足量的水中Cl
2+H
2O?HCl+HClO,1molCl
2完全反应转移电子物质的量为1mol,但该反应为可逆反应,所以反应中转移的电子总数小于N
A,故B错误;
C.在标准状况下 CH
2Cl
2和CHCl
3的混合物为液体,不是气体,不能用气体摩尔体积22.4L/mol,标准状况下,22.4LCH
2Cl
2和CHCl
3的混合物不一定是1mol,故C错误;
D.1个氮原子含有7个电子,1个氮气分子含有2个氮原子,所以1 mol N
2所含的电子数为14N
A,故D错误;
故选A.
点评:本题考查阿伏加德罗常数,注意从物质的组成、结构、气态摩尔体积的应用条件等方面进行解答,题目难度不大.

 ZnSO4+SO2↑+2H2O,从方程式可以看出1mol锌生成1mol二氧化硫气体,随着硫酸的消耗和水的生成,硫酸变稀,这是就会发生锌与稀硫酸反应,Zn+H2SO4=ZnSO4+H2↑,从方程式可以看出1mol锌生成1mol氢气,所以1mol锌无论与浓硫酸反应还是与稀硫酸反应,生成气体都为1mol,13 g锌的物质的量为n=
ZnSO4+SO2↑+2H2O,从方程式可以看出1mol锌生成1mol二氧化硫气体,随着硫酸的消耗和水的生成,硫酸变稀,这是就会发生锌与稀硫酸反应,Zn+H2SO4=ZnSO4+H2↑,从方程式可以看出1mol锌生成1mol氢气,所以1mol锌无论与浓硫酸反应还是与稀硫酸反应,生成气体都为1mol,13 g锌的物质的量为n= =
=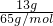 =0.2mol,生成气体分子数为0.2NA,故A正确;
=0.2mol,生成气体分子数为0.2NA,故A正确;
