
| A、升高温度,平衡逆向移动 |
| B、当容器中气体压强不变时,反应达到平衡 |
| C、平衡后加入X,上述反应的△H增大 |
| D、平衡后加入少量W,逆反应速率增大 |


科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+有氧化性 | 铁盐可用作净水剂 |
| B | SiO2是两性氧化物 | SiO2可和HF反应 |
| C | Al2O3的熔点很高 | Al2O3可用作耐火材料 |
| D | SO2有漂白性 | SO2可使高锰酸钾溶液褪色 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、铜与浓硫酸反应:Cu+4H++SO42-
| ||||
| B、氯气溶于水:Cl2+H2O=2H++Cl-+ClO- | ||||
| C、钠投入硫酸铜溶液中:2Na+Cu2+=2Na++Cu | ||||
D、实验室用MnO2和浓盐酸制Cl2:MnO2+4H++2Cl-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
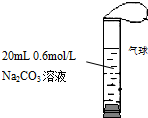 如图,将2mL浓度为6mol/L的盐酸用注射器通过橡皮塞慢慢注入,玻璃管中出现小气泡,气泡在溶液中逐渐上升的过程中消失.对该反应过程的推断不合理的是( )
如图,将2mL浓度为6mol/L的盐酸用注射器通过橡皮塞慢慢注入,玻璃管中出现小气泡,气泡在溶液中逐渐上升的过程中消失.对该反应过程的推断不合理的是( )| A、有反应CO32-+2H+=CO2↑+H2O发生 |
| B、有反应CO32-+H+=HCO3-发生 |
| C、有反应CO32-+CO2+H2O=2HCO3-发生 |
| D、加快盐酸注入速度不会改变反应现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 3 |
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,2L pH=1的H2SO4溶液中,SO42-数目为0.1NA |
| B、将7.8gNa2O2放入足量的CO2和水蒸气组成的气氛中,充分反应,转移电子总数为0.1 NA |
| C、9g重氧水(H218O)含电子总数为10 NA |
| D、常温常压下,2.24L正戊烷、异戊烷及新戊烷的混合物,含C-H数目为1.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com