
| A. | H3PO4 | B. | H2SO4 | C. | HClO4 | D. | HBrO4 |
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Na+、SO42ˉ、Clˉ | B. | H+、Ca2+、CO32ˉ、Clˉ | ||
| C. | K+、Na+、SO42ˉ、NO3ˉ | D. | Na+、NH4+、NO3ˉ、CO32ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .该物质中几种元素的第一电离能由大到小的顺序是N>O>C>H,该物质的晶体中肯定不存在的作用力是d.
.该物质中几种元素的第一电离能由大到小的顺序是N>O>C>H,该物质的晶体中肯定不存在的作用力是d.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 纤维编号 | ① | ② | ③ |
| 灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和乙烯均含有碳碳双键,均可使溴的CCl4溶液褪色 | |
| B. | 苯( )的一氯代物有一种,丙烷的一氯代物也有一种 )的一氯代物有一种,丙烷的一氯代物也有一种 | |
| C. | 乙醇和乙烯均可与酸性高锰酸钾发生反应 | |
| D. | 蔗糖和麦芽糖互为同分异构体,纤维素和淀粉也互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
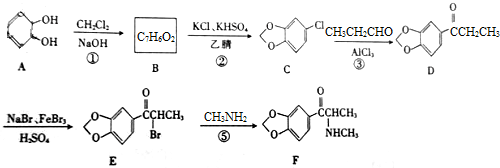

 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
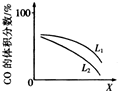 工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.
工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.| 时间/min 物质的量/mol 物质 | 0 | 2 | 4 | 6 | 8 | 10 |
| CO(g) | 0.100 | 0.070 | 0.050 | 0.044 | 0.040 | 0.040 |
| SO2(g) | 0.120 | 0.105 | 0.095 | 0.092 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com