
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ⑨ |
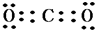 ,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为
,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为 ;用电子式表示元素③和⑨形成化合物的过程
;用电子式表示元素③和⑨形成化合物的过程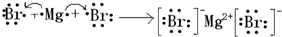
分析 根据元素在周期表中的分布知识,可以知道①是Na,②是K,③是Mg,④是Al,⑤是C,⑥是O,⑦是S,⑧是Cl,⑨是Br,⑩是Ar,
(1)10种元素中,化学性质最不活泼的是稀有气体Ar,除⑩外原子半径最大的是元素周期表左下角;
(2)电子层数越多半径越大,电子层数相同,核电荷数越多半径越大;
(3)⑥是氧和高价态的⑤是碳形成的化合物是二氧化碳,二氧化碳的电子式是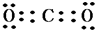 ,钠、氧两种元素能形成含共价键的离子化合物是氢氧化钠,氢氧化钠的电子式为
,钠、氧两种元素能形成含共价键的离子化合物是氢氧化钠,氢氧化钠的电子式为 ,元素镁和溴形成化合物的过程为:
,元素镁和溴形成化合物的过程为: ;
;
(4)O、S两种元素形成的简单氢化物,分别是水和硫化氢,水分子间存在氢键;
(5)Al和Cl两种元素最高价氧化物对应水化物分别是氢氧化铝和高氯酸,相互反应的离子方程式为:3H++Al(OH)3=3H2O+Al3+;
(6)氯的非金属性强于硫,所以可以用氯气氧化硫化氢,由此书写化学方程式;
(7)比较金属的活泼性可通过以下角度:①与或酸水反应的剧烈程度,②最高价氧化物对应的水化物的碱性,③单质之间的置换反应,④对应阳离子离子的氧化性强弱等,⑤金属活动性顺序表,⑥金属性越强电负性越小.
解答 解:(1)10种元素中,化学性质最不活泼的是稀有气体Ar,除⑩外原子半径最大的是元素周期表左下角,即K,故答案为:Ar;K;
(2)电子层数越多半径越大,电子层数相同,核电荷数越多半径越大,所以①、②、④、⑧四种元素形成的离子半径由大到小的顺序为Cl->K+>Na+>Al3+,故答案为:Cl->K+>Na+>Al3+;
(3)⑥是氧和高价态的⑤是碳形成的化合物是二氧化碳,二氧化碳的电子式是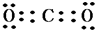 ,钠、氧两种元素能形成含共价键的离子化合物是氢氧化钠,氢氧化钠的电子式为
,钠、氧两种元素能形成含共价键的离子化合物是氢氧化钠,氢氧化钠的电子式为 ,元素镁和溴形成化合物的过程为:
,元素镁和溴形成化合物的过程为: ,故答案为:
,故答案为: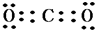 ;
; ;
; ;
;
(4)O、S两种元素形成的简单氢化物,分别是水和硫化氢,水分子间存在氢键,所以水沸点高于硫化氢,故答案为:H2O;水分子之间存在氢键;
(5)Al和Cl两种元素最高价氧化物对应水化物分别是氢氧化铝和高氯酸,相互反应的离子方程式为:3H++Al(OH)3=3H2O+Al3+,故答案为:3H++Al(OH)3=3H2O+Al3+;
(6)氯的非金属性强于硫,所以可以用氯气氧化硫化氢,反应方程式为:H2S+Cl2=2HCl+S↓,故答案为:H2S+Cl2=2HCl+S↓;
(7)比较金属的活泼性可通过以下角度:①与或酸水反应的剧烈程度,②最高价氧化物对应的水化物的碱性,③单质之间的置换反应,④对应阳离子离子的氧化性强弱等,⑤金属活动性顺序表,⑥金属性越强电负性越小,所以与最外层电子数的多少、电子层数和转移电子的多少无关,故选D.
点评 本题考查学生元素元素周期表的结构和周期律的应用知识,可以根据所学知识进行回答,难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1.
,F原子的电子排布式是1s22s22p63s23p63d104s1. .DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.
.DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能与H2O2反应生成H2SO4 | |
| B. | 利用Cl2与石灰乳反应可以制取漂白粉 | |
| C. | Cl2能使紫色石蕊试液先变红后褪色 | |
| D. | 红热的铁丝能在Cl2中剧烈燃烧产生大量的白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | 元素的性质呈周期性变化的根本原因是核外电子排布呈周期性变化 | |
| C. | 第IA族元素与第VIIA族元素形成的化合物都是离子化合物 | |
| D. | 元素周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦⑧ | B. | ③④⑦⑧ | C. | ②⑤⑧⑨ | D. | ④⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素一定在第三周期 | |
| B. | 该元素一定在第二周期 | |
| C. | 若该离子是阳离子,则该元素一定在第三周期 | |
| D. | 若该离子是阴离子,则该元素一定在第三周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的沸点高于乙醛是因为乙醇分子间存在氢键,而乙醛分子间只有范德华力 | |
| B. | 单质碘易溶于CCl4而微溶于水,是因为I2和CCl4都是非极性分子而水是极性分子 | |
| C. | NH3与CH4的空间构型不同是因为NH3中存在孤电子对而CH4中只有成键电子对 | |
| D. | 水分子比硫化氢稳定是因为水分子存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | Ba(OH)2溶液与稀硫酸反应:Ba2++OHˉ+H++SO42-═BaSO4↓+H2O | |
| C. | CaCO3中加入稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | Mg(OH)2与盐酸反应:OHˉ+2H+═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com