
| A. | 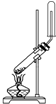 用氯化铵和氢氧化钙制NH3 | B. | 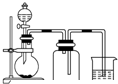 二氧化锰和浓盐酸制氯气 | ||
| C. | 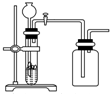 用锌粒和稀硫酸制H2 | D. | 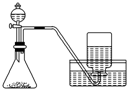 用双氧水和二氧化锰制O2 |
分析 A.反应在加热条件下进行,应防止试管炸裂;
B.二氧化锰和浓盐酸常温下不反应;
C.氢气的密度比空气小;
D.双氧水在二氧化锰催化作用下可生成氧气,氧气可用排水法收集.
解答 解:A.氯化铵和氢氧化钙反应制取氨气,生成物中有水,如果试管口高于试管底,会发生水倒流现象而炸裂试管,且试管口应塞一团棉花,防止氨气与空气对流,故A错误;
B.二氧化锰和浓盐酸在加热条件下反应制备氯气,常温下不反应,且氯气密度比空气大,用向上排空法收集,故B错误;
C.锌粒和盐酸反应制取氢气,属于固体、液体不加热型,生成的氢气的密度小于空气的密度,所以不可用向上排空气法收,故C错误;
D.用过氧化氢与二氧化锰制O2,属于固体、液体不加热型,生成的氧气不易溶于水,所以可采用排水集气法收集,故D正确;
故选D.
点评 本题考查综合考查常见气体制备原理及装置选择,为高频考点,根据反应物的状态及反应条件,可把实验室制备气体发生装置分为:固体、固体加热型,如加热高锰酸钾制取氧气;固体、液体加热型,如制取氯气;固体、液体不加热型,如用稀硫酸和锌粒制取氢气,答题时注意把握物质的性质以及实验的严密性、可行性的评价,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| B. | 浓硝酸具有不稳定性,实验室里应保存在棕色瓶中 | |
| C. | 常温下,浓硝酸可以跟铜缓慢反应,浓硫酸可与铜片迅速反应 | |
| D. | 实验室可以用浓硝酸来制氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
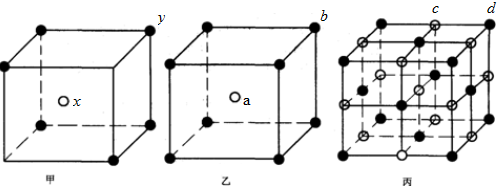
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
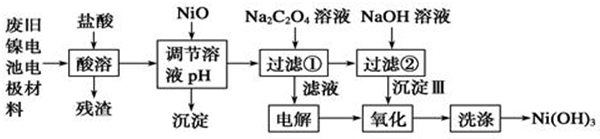
| Ksp | 开始沉淀pH | 沉淀完全pH | |
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
| NiC2O4 | 4.0×10-10 | -- | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度 时间(s) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热(t1℃) | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热(t2℃) | 360(a) | 480 | 540 | 720 |
| MnO2催化剂、加热(t2℃) | 10(b) | 25 | 60 | 120 |
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从整个循环来看,利用该方法得到的氢能来源于太阳能 | |
| B. | 上述制氢气的化学方程式可表示为:(C6H10O5)n+7nH2O$\stackrel{酶}{→}$ 6nCO2↑+12nH2↑ | |
| C. | 氢元素的三种同素异形体${\;}_{1}^{1}H$、${\;}_{1}^{2}H$、${\;}_{1}^{3}H$,能形成六种单质 | |
| D. | 从化学的本质看该反应属于氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com