
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 ,该离子的符号为
,该离子的符号为 所示,写出它的化学式
所示,写出它的化学式 ,其质子数大于核外电子数,其质子数=原子序数,所以该元素为Mg元素,质子数大于核外电子数,所以该离子为带两个正电荷的阳离子;
,其质子数大于核外电子数,其质子数=原子序数,所以该元素为Mg元素,质子数大于核外电子数,所以该离子为带两个正电荷的阳离子; ,根据其离子结构示意图知,质子数-电子数=2,其原子序数是12,所以该离子为Mg 2+,故答案为:Mg 2+;
,根据其离子结构示意图知,质子数-电子数=2,其原子序数是12,所以该离子为Mg 2+,故答案为:Mg 2+;| 14×2 |
| 1×4 |


科目:高中化学 来源: 题型:
| A、Ag++Cl-=AgCl↓ |
| B、AgNO3+Cl-=AgCl↓+NO3- |
| C、NaCl+Ag+=AgCl↓+Na+ |
| D、Ag++NO3-+Na++Cl-=AgCl↓+NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.(1)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液中c(Na+)
Ⅰ.(1)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液中c(Na+)查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
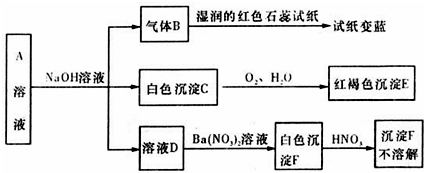
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
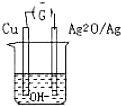 普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )| A、工业上以黏土、石灰石为主要原料来制造水泥 |
| B、测量原理示意图中 Ag2O为负极 |
| C、负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O |
| D、电池工作时OH-向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com