
| A. | 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 | |
| B. | 滴定达到终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 | |
| D. | 随着NaOH溶液的滴入,锥形瓶中的pH由小变大 |
分析 A.滴定管使用必须用NaOH标准液润洗;
B.滴定终点时,发现滴定管尖嘴部分有悬滴,则消耗的标准液偏大;
C.用酚酞作指示剂,滴定前锥形瓶中为无色溶液;
D.碱滴定酸,氢离子浓度逐渐减小.
解答 解:A.滴定管使用必须用NaOH标准液润洗,否则消耗的标准液偏大,测定酸的浓度偏大,故A错误;
B.滴定终点时,发现滴定管尖嘴部分有悬滴,则消耗的标准液偏大,则测定酸的浓度偏大,故B错误;
C.用酚酞作指示剂,滴定前锥形瓶中为无色溶液,则当锥形瓶中溶液由无色变红色时停止滴定,故C错误;
D.碱滴定酸,氢离子浓度逐渐减小,则随着NaOH溶液滴入,锥形瓶中溶液pH由小变大,故D正确;
故选D.
点评 本题考查中和滴定及误差分析,题目难度不大,侧重中和滴定实验的操作方法考查,明确中和滴定原理、仪器的使用、误差分析为解答的关键,注重分析与实验能力的结合.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
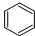 c.
c.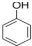
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲烷,丙炔 | B. | 甲烷,丁炔 | C. | 乙烷,乙炔 | D. | 乙烷,丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
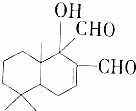
| A. | 既能发生氧化反应,又能发生酯化反应 | |
| B. | 与FeC13溶液发生反应后,溶液显紫色 | |
| C. | 1mol该有机物最多可与2molCu(0H)2反应 | |
| D. | 1mol该有机物最多可与1molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应将混合物中的水分蒸干后,才能停止加热 | |
| B. | 用Ba(NO3)2溶液鉴别Cl-、SO42和CO32- | |
| C. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| D. | 可以用溶解过滤的方法从加热氯酸钾和二氧化锰的混合物中获得二氧化锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
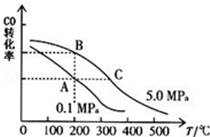 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
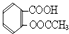 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:

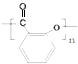 .
.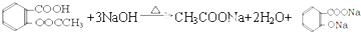 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com