
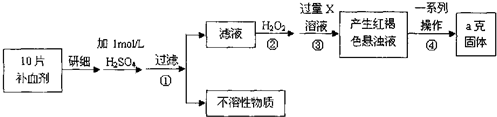
分析 (1)双氧水具有氧化性,还原产物是水;
(2)步骤③中三价铁和碱反应生成氢氧化铁沉淀;
(3)根据铁元素守恒类解答;
(4)①根据配制一定物质的量浓度的溶液所需要的仪器来回答;
②硝酸、高锰酸钾有强氧化性、盐酸具有还原性;
③高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察;
(5)根据铁元素守恒进行计算.
解答 解:(1)双氧水具有氧化性,能将Fe2+全部氧化为Fe3+,
故答案为:将Fe2+全部氧化为Fe3+;
(2)步骤③加入碱溶液,铁离子与碱反应生成氢氧化铁红褐色沉淀,所以加入的X为碱,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓(或Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+),
故答案为:Fe3++3OH-=Fe(OH)3↓(或Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+);
(3)最终固体为Fe2O3,铁元素的质量百分数为:$\frac{56×2}{56×2+16×3}$×100%=70%,所以ag固体中铁元素0.7ag,所以10片补血剂含铁元素的质量0.7ag,则每片补血剂含铁元素的质量0.07ag,
故答案为:0.07a;
(4)①根据配制一定物质的量浓度的溶液所需要的仪器有:250mL容量瓶、天平、玻棒、烧杯、量筒、药匙、胶头滴管,
故答案为:250mL容量瓶;
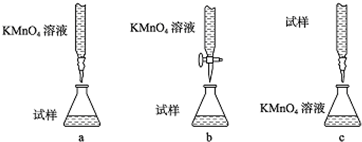
②高锰酸钾有强氧化性,能将盐酸氧化,硝酸具有氧化性,能亚铁离子氧化,故只能用稀硫酸酸化,
故答案为:b;
③高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察,应将高锰酸钾滴到待测液中,
故答案为:b;
(5)根据铁元素守恒,14mg的铁即为FeSO4•7H2O片剂中铁的质量,所以需要FeSO4•7H2O片剂质量为:$\frac{14mg}{\frac{56}{278}}$=69.5mg,
故答案为:69.5mg.
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度中等,明确实验目的、实验原理为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的实质是化合价变化 | |
| B. | 具有氧化性的物质在反应中一定做氧化剂 | |
| C. | 氧化剂氧化其他物质时,本身被还原 | |
| D. | 还原剂在反应中本身被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与足量Cu共热,转移的电子为ab mol | |
| B. | 常温时加入Al,不会发生化学反应 | |
| C. | 若加入mg Zn片,Zn片完全溶解,可收集到的标准状况下气体体积为22.4m/65 L | |
| D. | 蔗糖与浓硫酸混合,只体现浓硫酸的脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将过量CO2气体通入水玻璃中可制得硅酸和纯碱 | |
| B. | 标准状况下,2.24LCl2与过量稀NaOH溶液反应,转移电子0.1mol | |
| C. | 1L2mol•L-1明矾经水解可得到氢氧化铝胶体粒子数目为2×6.02×1023 | |
| D. | 漂白粉溶于水能导电,故漂白粉是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加Al放出H2的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | 由水电离出的c(OH-)=1.0×10-2 mol•L-1的溶液:Cl-、CH3COO-、K+、AlO2- | |
| C. | 水电离出的c(H+)=$\sqrt{Kw}$的溶液中:Na+、SO42-、CO32-、K+ | |
| D. | $\frac{c(OH-)}{c(H+)}$=1012的溶液中,NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨晶体内既有共价键又有分子间作用力 | |
| B. | 石墨晶体熔沸点很高,硬度很大 | |
| C. | 石墨晶体内每个六边形平均含完整碳原子2个 | |
| D. | 石墨晶体中,每个C原子连接3个六元环 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com