
某无色溶液中,可大量共存的离子组是( )
A.Na+、HCO3-、SO42-、Br-
B.Cu2+、NO3-、Cl-、SO42-
C.H+、Cl-、K+、CO32-
D.K+、Mg2+、SO42-、OH-
科目:高中化学 来源: 题型:
在400 ℃、101 kPa,将SO2和14 mol O2装入一个有催化剂的5 L密闭容器中,发生了2SO2(g)+O2(g)  2SO3(g)的反应,10 min时达到平衡时,测得容器内有2 mol SO2和12 mol O2 。则:(提示:用三步法)
2SO3(g)的反应,10 min时达到平衡时,测得容器内有2 mol SO2和12 mol O2 。则:(提示:用三步法)
(1)SO2的起始浓度
(2)平衡体系中含SO3的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
现有X、Y、Z三种非金属元素,A、B、C三种金属元素,已知有如下情况:
(1)X、Y、Z的单质在常温下均为气体。
(2)X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
(3)XZ易溶于水,XZ的水溶液可使紫色石蕊试液变红。
(4)2 mol X的单质可与1 mol Y的单质化合生成2 mol X2Y,X2Y常温下为液体。
(5)A的单质可以在z的单质中燃烧,生成棕黄色固体,该固体溶于水呈棕黄色溶液。
(6)B与Z形成的化合物BZ2溶于水加入NaOH溶液有蓝色沉淀生成。
(7)C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色。
请完成下列问题:
①写出XZ、X2Y和BZ2的化学式:XZ________,X2Y________,BZ2________。
②A的单质与Z的单质反应的化学方程式:________________。
③C的单质与Y单质反应生成淡黄色物质的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
草木灰是柴草燃烧后形成的灰肥,是一种质地疏松的热性速效肥。其中富含钾盐,主要成分为碳酸钾,还含有少量的氯化钾和硫酸钾。先从草木灰中提取钾盐,并用实验检验其中的SO 和Cl-。
和Cl-。
(1)此实验的操作顺序如下:①称量样品;②溶解沉降;③__________;④__________;⑤冷却结晶。
(2)用托盘天平(指针向上)称量样品时,若指针偏向右边,则表示( )
A.左盘重,样品轻
B.左盘轻,砝码重
C.右盘重,砝码轻
D.右盘轻,样品重
(3)在进行第③步操作时,有时可能要重复进行,这是由于_____________________。
(4)在进行第③、④步操作时,都要用到玻璃棒,其作用分别是
③________________________________________________________________________,
④________________________________________。
(5)将制得的少量晶体放入试管中,加蒸馏水溶解后分成两份,分别装在两支试管中。在第一支试管中加入足量的盐酸,再加入BaCl2溶液,观察到有__________生成,证明溶液中有__________(填离子符号)。在第二支试管中加入足量的稀硝酸,再加入AgNO3溶液,观察到有__________生成,证明溶液中有__________(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子反应不能发生的是( )
A.KHCO3+HCl===KCl+CO2↑+H2O
B.AgNO3+NaCl===AgCl↓+NaNO3
C.Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
D.2HCl+Na2SO4===2NaCl+H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:____________________________________________;
②KHSO4:_____________________________________________;
③HNO3:_______________________________________________;
④Na2CO3:_____________________________________________;
(2)按酸、碱、盐分类,其中,属于酸的是________,属于碱的是________,属于盐的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在实验报告中记录下列数据,其中正确的是( )
A.用25mL量筒量取12.36mL盐酸 B.用托盘天平称量8.75g食盐
C.用500mL的容量瓶配制450mL溶液 D.用广泛pH试纸测得某溶液的pH为3.5
查看答案和解析>>
科目:高中化学 来源: 题型:
同温、同压下,下列有关比较等质量的二氧化硫气体和二氧化碳气体的叙述中正确的是( )
A.密度比为16:11 B.密度比为11:16 C.体积比为16:11 D.体积比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化铝钠(NaAlH4)是最有研究应用前景的络合金属氢化物,氢化铝钠储放氢时发生反
应:3NaAlH4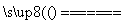 Na3AlH6+2Al+3H2↑。下列说法正确的是( )
Na3AlH6+2Al+3H2↑。下列说法正确的是( )
A. NaAlH4中氢元素为+1价
B.每生成11. 2 L(标准状况下)H2,转移2NA个电子
C.反应中氧化产物与还原产物的物质的量之比为1: 1
D.在反应中有50%的氢被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com