


科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 L水中含有1 mol NaCl | B.溶液中含有1 mol NaCl |
| C.1 L溶液中含有58.5 g NaCl | D.将58.5 g NaCl溶于1 L水中所得的溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质的量(n) | B.物质的量浓度(c) | C.质量分数(w) | D.摩尔质量(M) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.已知N2(g)+3H2(g)  2NH3(g)△H=-92.4 kJ·mol-1,当有3NA个电子转移时,△H变为-46.2 kJ·mol-1 2NH3(g)△H=-92.4 kJ·mol-1,当有3NA个电子转移时,△H变为-46.2 kJ·mol-1 |
| B.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 |
| C.由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
| D.2.9g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.01NA个 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
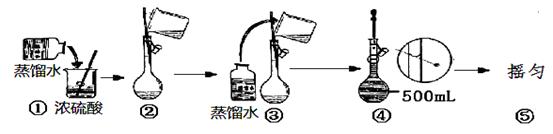

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B.2 g H2所含有的原子数目是NA |
| C.18 g H2O在标准状况下的体积是22.4 L |
| D.在标准状况时,20 mL NH3与60 mL O2所含的分子个数比为2:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.体积④<①<②<③ | B.密度①<④<③<② |
| C.原子数④<③<②<① | D.质量④<①<③<② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| b的取值范围(mol) | 溶质的成份 | 溶质的质量(g) |
| b<4a×10- 4 | | |
| | Na2CO3、NaHCO3 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com