
【题目】下列对有关文献的理解错误的是
A. 《汉书》中“高奴县有洧水可燃”,《梦溪笔谈》对“洧水”的使用有“试扫其烟为墨,黑光如漆,松墨不及也”的描述,其中的烟指炭黑
B. 《物理小识》记载“青矾(绿矾)厂气熏人,衣服当之易烂,栽木不茂”,青矾厂气是CO和CO2
C. 《本草纲目》描述“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”其中的碱是K2CO3
D. 《天工开物》记裁制造青瓦“(窑)泥周寒其孔,浇水转釉”,红瓦转化为青瓦的原因是Fe2O3转化为其他铁的氧化物
【答案】B
【解析】洧水可燃,洧水是石油,不完全燃烧时有碳颗粒生成,由墨汁很黑知道烟是炭黑,A说法正确;青矾是绿矾,为硫酸亚铁晶体FeSO47H2O,青矾”强热,得赤色固体为氧化铁,“气”凝即得“矾油”,矾油应指硫酸,具有腐蚀性,根据电子得失守恒和元素守恒可知,煅烧FeSO47H2O制氧化铁的化学方程式为2FeSO47H2O![]() Fe2O3+SO2↑+SO3↑+7H2O,所以青矾厂气指的是SO2和SO3气体,不是CO和CO2,B说法错误;冬月灶中所烧薪柴之灰即草木灰,草木灰的主要成分是碳酸钾,用水溶解时碳酸钾水解导致溶液呈碱性,能够去污,所以C说法正确;红瓦和青瓦都是用泥土制成的,青瓦和红瓦是在冷却时区分的,自然冷却的是红瓦,水冷却的是青瓦,红瓦里面是氧化铁,青瓦里面主要是氧化亚铁,所以D说法正确;正确选项B。
Fe2O3+SO2↑+SO3↑+7H2O,所以青矾厂气指的是SO2和SO3气体,不是CO和CO2,B说法错误;冬月灶中所烧薪柴之灰即草木灰,草木灰的主要成分是碳酸钾,用水溶解时碳酸钾水解导致溶液呈碱性,能够去污,所以C说法正确;红瓦和青瓦都是用泥土制成的,青瓦和红瓦是在冷却时区分的,自然冷却的是红瓦,水冷却的是青瓦,红瓦里面是氧化铁,青瓦里面主要是氧化亚铁,所以D说法正确;正确选项B。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】铁元素在电化学中应用广泛。回答下列问题:
(1)根据反应2Fe3++Cu==2Fe2++Cu2+设计原电池如图。电流计显示电流方向为:a→b。

①电极B为____________,电解质溶液C为_____________。(填标号)
A,碳棒 B.铜片 C.Fe2(SO4)3溶液 D.CUSO4溶液
②A电极的电极反应式为________________________________________。
③用该电池做电源,电解硫酸钠溶液,当电解池阳极有11.2mL气体(标准状况)产生时,该电池有__________________molFe3+被还原。
(2)NaFeO4是一种用途广泛的化工产品,工业上常用电解法制取。制取装置如图。已知Na2FeO4只在强碱性条件下比较稳定,具有强氧化性。

①Na2FeO4中铁元素化合价为_____________ Na2FeO4是具有杀菌效果的净水剂。原因是_________________________________________________。
②电极Ni为_________________(填“阳”或“阴”)极。为使该装置能持续反应,离子交换膜应为__________________________(填“阳”或“阴”)离子交换膜。
③阳极反应式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是

A. 电极Y为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-181.6 kJ·mol-1;
CH3OH(g)+H2O(g) ΔH1=-181.6 kJ·mol-1;
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1。
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式:________________________________________________________________________。
(2)在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=______________________________;KA、KB、KC三者之间的大小关系为______________________________。
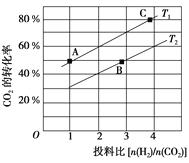
(3)若2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是________(填序号)。
CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是________(填序号)。
A.CO和H2的物质的量浓度之比是1∶2
B.CO的消耗速率等于CH3OCH3的生成速率的2倍
C.容器中混合气体的体积保持不变
D.容器中混合气体的平均摩尔质量保持不变
E.容器中混合气体的密度保持不变
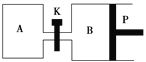
(4)如图P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH转化率为________;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
CO2(g)+3H2(g)。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH转化率为________;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(5)CO2溶于水形成H2CO3。已知常温下H2CO3的电离平衡常数为K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离平衡常数为K=1.75×10-5。常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显________(填“酸性”“中性”或“碱性”);请计算反应NH+HCO+H2O![]() NH3·H2O+H2CO3的平衡常数K=________________________________________________________________________。
NH3·H2O+H2CO3的平衡常数K=________________________________________________________________________。
(6)工业上采用电化学还原CO2是一种使CO2资源化利用的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应),下列说法正确的是____________。
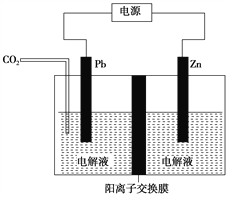
A.Zn与电源的负极相连
B.ZnC2O4在交换膜右侧生成
C.电解的总反应式为2CO2+Zn![]() ZnC2O4
ZnC2O4
D.通入11.2 L CO2,转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向25mL 0.1000mo1·L-1 HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示。下列有关叙述错误的是
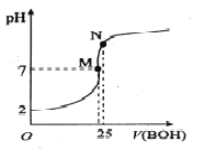
A. BA溶液呈碱性
B. 酸HA的电离常数约为0.0011
C. M点时c(B+)=c(A-)> c(H+)= c(OH-)
D. N点时加入10mL0.1mol/L HA溶液,将促进A-的水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】书写化学反应方程式是高中僧的必备技能,快来闯关吧!
(1)钠加入到三氯化铁溶液中发生的反应(总方程式):_________________________________________________________________
(2)过氧化钠与水的反应:_________________________________________________________________
(3)过氧化钠与二氧化碳的反应:_________________________________________________________________
(4)碳酸氢钠与氢氧化钠的反应: _________________________________________________________________
(5)碳酸氢钠受热分解: _________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的钙离子、镁离子、硫酸根离子及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
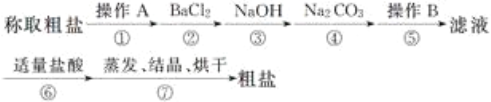
(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为氯化钙)____________________________。
(3)若先用盐酸调溶液至中性,再过滤,将对实验结果产生影响,其原因是_________________________。
(4)判断氯化钡已过量的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质或应用正确的是( )
A.钠与硫酸铜溶液反应会置换出红色的铜
B.常温下干燥氯气与铁不反应,可以用钢瓶储存液氯
C.SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色
D.普通玻璃的组成可用Na2OCaO6SiO2表示,是纯净物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com