
对于反应H― + NH3=H2 + NH2―的不正确的说法是
A.属于置换反应
B.H―是还原剂
C.H2既是氧化产物又是还原产物
D.氧化产物与还原产物的化学计量数之比为1:1
科目:高中化学 来源: 题型:阅读理解
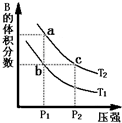 对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.
对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(B)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(A)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:| c(H2)?c(CO) |
| c(H2O) |
| c(H2)?c(CO) |
| c(H2O) |
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CuO/CuCl3 | 400℃ |



 2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol 2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com