
下列有关物质检验的实验结论正确的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入2滴含[Fe(CN)6]3-溶液,出现蓝色沉淀。 | 该溶液中一定含有Fe2+ |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 某气体能使湿润的蓝色石蕊试纸变红 | 该气体是NH3 |
| D | 将少量某有机物滴加到新制氢氧化铜中,充分振荡,未见砖红色沉淀生成 | 该有机物不含醛基 |
科目:高中化学 来源: 题型:
某氯化镁溶液的密度为1.18 g·cm―3,其中镁离子的质量分数为5.1%,300 mL该溶液中Cl―离子的物质的量约等于( )
A.0.37 mol B.0.63 mol C.0.74 mol D.1.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
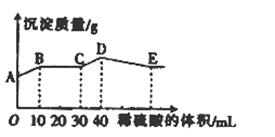
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
A.AB段发生反应的的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.BC段发生反应的离子方程式为:H++OH-=H2O
C.D点表示的沉淀的化学式为Al(OH)3、BaSO4
D.E点表示的溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。
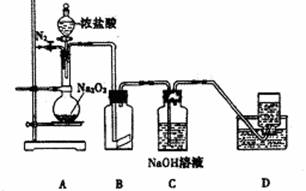
实验步骤及现象如下:
①检查装置气密性后,装人药品并连接仪器:
②缓慢通人一定量的N2后,将装置D连接好(导管末端未伸人集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸人集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通人一定量的N2,至装置中气体无色。
(1) 装置B中的湿润的红色纸条褪色,证明A中反应有_______(填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因____________________________________________
(2) 装置C的作用是______________________________________________
(3) 甲同学认为O2是 Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①____________________________________;②______________________________
(4) 实验证明,Na2O2与干燥的HCl能反应,得到Cl2,请写出该的化学方程式:
_____________________________________________________;
该反应一般不用于实验室快速制取纯净的Cl2,理由是________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)  N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10 min内,NO的平均反应速率v(NO)=_______________________,T1℃时,该反应的平衡常数K=______________________________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________ (填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30 min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q______________ (填“>”、“=”或“<”)0。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
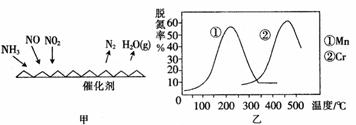
①由图甲可知,SCR技术中的氧化剂为_______________。已知c(NO2):c(NO)=1:1时脱氮效果最佳,若生成1 mol N2时反应放出的热量为Q kJ。此时对应的脱氮反应的热化学方程式为__________________________。
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为___________________________。
(3)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收。该温度下,吸收液中c(Ca2+)一直保持为0.70 mol·L-1,已知Ksp(CaSO3)=1.4×10-7,求吸收后溶液中的SO32-的浓度_______________。(写出计算过程,结果保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
有关氯水的下列叙述中,正确的是( )
A.新制氯水中只有Cl2和H2O两种分子
B.新制氯水可使蓝色石蕊试纸先变红后退色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后,酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
硅是重要的半导体材料,构成了现代电子工业的基础。
(1)基态Si原子中,电子占据的最高能层符号为____________。
(2)硅也有系列氢化物-----硅烷,SiH4分子中H原子的1s轨道与Si原子的__________轨道重叠形成Si—H σ键。
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,这种变化关系原因是
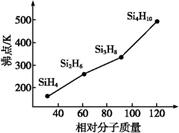
___________________________________________________________________________。
(4)科学家们在高温高压下将CO2制成与SiO2结构类似的新型CO2晶体。这种新型CO2晶体与SiO2相比,熔点更高的是____________________;原因是__________________
___________________________________________________________________________。
(5)在硅酸盐中,Si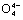 四面体[如下图(a)]通过共用顶角氧离子可形成多种结构型式。图(b)为一种无限长单链结构的多硅酸根X;
四面体[如下图(a)]通过共用顶角氧离子可形成多种结构型式。图(b)为一种无限长单链结构的多硅酸根X;
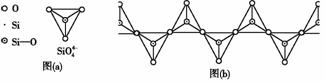
X中Si与O的原子数之比为________________,化学式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com