
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
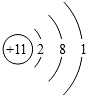 ;
;分析 元素在周期表中的位置可知,①为H,②为C,③为N,④为F,⑤为Na,⑥为Mg,⑦为Al,⑧为Si,⑨为S,⑩为Cl,
(1)在这些元素中,非金属性最强为F;
(2)⑧元素的氢化物为硅烷;
(3)金属性最活泼的元素为Na;
(4)能用来雕刻玻璃的氢化物为氢氟酸;
(5)电子层越多,原子半径越大,同周期原子序数大的原子半径小;
(6)③元素的气态氢化物和⑨元素的最高价氧化物对应水化物反应生成硫酸铵;
(7)金属性越强,最高价氧化物对应的水化物的碱性越强;
(8)利用与氢气化合的难易程度、氢化物的稳定性、最高价含氧酸的酸性、得电子能力证明元素⑩比元素⑨的非金属性强.
解答 解:元素在周期表中的位置可知,①为H,②为C,③为N,④为F,⑤为Na,⑥为Mg,⑦为Al,⑧为Si,⑨为S,⑩为Cl,
(1)在这些元素中,非金属性最强为F,故答案为:F;
(2)⑧元素的氢化物为硅烷,化学式为SiH4,故答案为:SiH4;
(3)金属性最活泼的元素为Na,原子结构示意图为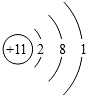 ,故答案为:
,故答案为: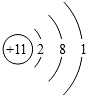 ;
;
(4)能用来雕刻玻璃的氢化物为氢氟酸,化学式为HF,故答案为:HF;
(5)电子层越多,原子半径越大,同周期原子序数大的原子半径小,则④、⑨、⑩三种元素的原子半径由大到小的排列顺序为S>Cl>F,故答案为:S>Cl>F;
(6)③元素的气态氢化物和⑨元素的最高价氧化物对应水化物反应生成硫酸铵,反应为2NH3+H2SO4=(NH4)2SO4,故答案为:2NH3+H2SO4=(NH4)2SO4;
(7)金属性越强,最高价氧化物对应的水化物的碱性越强,则⑤、⑥、⑦三种元素中,最高价氧化物对应的水化物的碱性最强的是NaOH,故答案为:NaOH;
(8)A.常温下⑩单质的密度小于⑨单质的密度,密度不能比较非金属性,故A不选
B.⑩元素的气态氢化物比⑨元素的气态氢化物更稳定,可知非金属性Cl的强,故B选;
C.⑩单质与氢气反应的程度比⑨单质与氢气反应的程度更剧烈,可知非金属性Cl的强,故C选;
D.非金属性Cl>S,应为⑨元素的最高价氧化物对应的水化物酸性小于⑩元素的最高价氧化物对应的水化物,故D不选;
故选BC.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物知识为解答的关键,侧重分析与应用算能力的考查,注意规律性知识及元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都可以设计成电解池反应 | |
| B. | 电解冶炼镁、铝通常电解MgCl2和Al2O3,也可电解MgO和 | |
| C. | 若把Cu+H2SO4═CuSO4+H2↑设计成电解池,应用Cu作阳极 | |
| D. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海带中的碘可以直接用四氯化碳萃取 | |
| B. | 在蒸发皿中灼烧海带使之变为海带灰 | |
| C. | 将海带灰溶于水中,滴加淀粉溶液,溶液变蓝 | |
| D. | 为了将I-氧化,加入的氧化剂最好选择H2O2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol/L•min | B. | 0.6 mol/(L•min) | C. | 0.9 mol/(L•min) | D. | 1.2 mol/L•min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2的电子式为?X??X? | B. | X位于元素周期表中第ⅤA族 | ||
| C. | X元素原子的最外层有7个电子 | D. | X可能位于元素周期表中第二周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成电池的两极必须是活泼性不同的金属 | |
| B. | 锌锰干电池工作时,锌作负极 | |
| C. | 在电池中,电子流出的一极是负极,发生还原反应 | |
| D. | 银锌纽扣电池工作时,电子由锌极流出经过溶液后流向银极 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物水化物的酸性为同主族最强 |
| E | E元素的核电荷数等于A原子的核电荷数和B元素氢化物的核电荷数之和 |
 ,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯在常温常压下是气体,能使溴的四氯化碳溶液褪色 | |
| B. | 苯可做有机溶剂,能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇和乙烷都能发生取代反应 | |
| D. | 乙酸乙酯在酸性条件下可以水解生成乙酸和乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com