
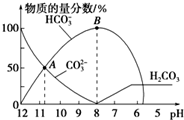
| A. | 在A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 在B点所示的溶液中,浓度最大的离子是Na+ | |
| C. | 当溶液的pH为7时,溶液的总体积大于20mL | |
| D. | 25℃时,CO32-水解常数Kh=2×10-4mol•L-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10 |
分析 A.任何电解质溶液中都存在电荷守恒,阴阳离子所带电荷总数相同;
B.根据电荷守恒判断各离子浓度大小;
C.当混合溶液体积为20mL时,二者恰好反应生成NaHCO3,HCO3-的电离程度小于其水解程度,所以其溶液呈碱性;
D.常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,以此分析解答.
解答 解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),故A错误;
B.B点溶液呈碱性,溶液中存在电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),由于氢离子浓度较小,则离子浓度最大的为钠离子,故B正确;
C.当混合溶液体积为20mL时,二者恰好反应生成NaHCO3,HCO3-的电离程度小于其水解程度,所以其溶液呈碱性,要使混合溶液呈中性,则酸稍微过量,所以混合溶液体积稍微大于20mL,故C正确;
D.水解常数Kh=$\frac{c(HC{{O}_{3}}^{-})c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,c(OH-)=10-4mol/L,由Kw可知,c(H+)=10-10mol/L,所以pH=10,故D正确;
故选A.
点评 本题考查了离子浓度大小的比较,题目难度中等,明确反应后溶质组成为解答关键,注意根据物料守恒、电荷守恒进行分析解答,试题侧重考查学生的分析、理解能力.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 由非金属元素形成的某些共价化合物的熔点高于某些金属单质的熔点 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 目前使用的元素周期表中,最长的周期含有18种元素 | |
| D. | 由短周期非金属元素形成的纯净物中,相邻原子之间最多只能共用2对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
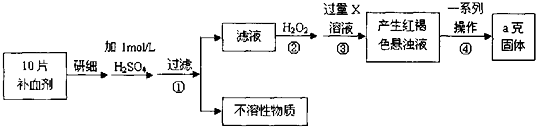
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{576v}$mol/L | B. | $\frac{125a}{36v}$mol/L | C. | $\frac{250a}{36v}$mol/L | D. | $\frac{250a}{48v}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
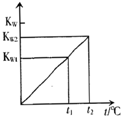 水的离子积常数KW与温度t(℃)的关系如图所示:
水的离子积常数KW与温度t(℃)的关系如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com