
【题目】下列判断错误的是
A. 稳定性:H2O>NH3>CH4B. 原子半径:N<O<F
C. 酸性:HClO4>H2SO4>H3PO4D. 碱性:NaOH>Mg(OH)2>Al(OH)3
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
A.a点对应的溶液中:Na+、OH-、SO42-、NO3-
B.b点对应的溶液中:H+、Fe3+、MnO4-、Cl-
C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D.d点对应的溶液中:S2-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族.回答下列问题:
(1)X的电子排布式为 , Y的电子排布图为;
(2)ZX2的分子式是 , YX2电子式是;
(3)Y与Z形成的化合物的分子式是 , 该化合物中化学键的种类是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物用途非常广泛,目前世界上60%的镁是从海水中提取.从海水中先将海水淡化获得淡水和浓海水,浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl﹣ | SO42﹣ |
浓度/(gL﹣1) | 63.7 | 28.8 | 144.6 | 46.4 |
再利用浓海水提镁的一段工艺流程如下图:
请回答下列问题
(1)浓海水主要含有的四种离子中物质的量浓度最小的是 . 在上述流程中,可以循环使用的物质是 .
(2)在该工艺过程中,X试剂的化学式为 .
(3)“一段脱水”目的是制备MgCl22H2O;“二段脱水”的目的是制备电解原料.若将MgCl26H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为 .
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为g.
(5)以LiCl﹣KCl共熔盐为电解质的Mg﹣V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl MgCl2+V2O4Li2O 该电池的正极反应式为 .
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则: Mg(s)+2B(s) MgB2(s)△H= . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素的原子的L层比B元素的L层少3个电子,B元素原子核外电子比A元素总电子数多5个,则A、B可形成
A. 共价化合物B2A3B. 离子化合物B2A3
C. 共价化合物B3A2D. 离子化合物B3A2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaClO3制取ClO2气体,再由ClO2制得NaClO2 , 实验装置如图所示:回答下列问题: 
(1)仪器a的名称为;装置C的作用是 .
(2)该实验必须使NaClO3稍微过量,目的是 .
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意 .
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2﹣ , 则另一种为 .
(5)B中反应的离子方程式为 .
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2 , 加入(填序号,下同)酸化,再加入检验. ①稀HNO3②稀H2SO4③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9g NaClO23H2O(相对质量:144.5),至少需g NaClO3(相对质量:106.5).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,在4.0L恒容密闭容器中充入2.0mol PCl5 , 发生反应:PCl5(g)PCl3(g)+Cl2(g),反应时间(t)与容器内气体总压强(p)的数据见表:
t/s | 0 | 50 | 150 | 250 | 350 |
总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
(1)由总压强p和起始压强p0计算反应物PCl5的转化率α(PCl5)的表达式为?平衡时PCl5的转化率为多少?
(2)反应在前50s的平均速率v(PCl3)为多少?
(3)该温度下的平衡常数为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读、分析下列两个材料:
材料一:如图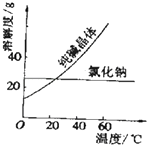
材料二:如表
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇C2H6O2 | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 跟水、酒精以任意比互溶 |
根据上述材料及课本知识,回答下列问题(每空只填一个字母选项,):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
(1)分离汽油和水的最佳方法是;
(2)去除纯碱中的少量氯化钠杂质,最好应用;
(3)将乙二醇和丙三醇相互分离的最佳方法是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com