
| A. | HCl→H++Cl- | B. | H2CO3?2H++CO32- | ||
| C. | NaCl→Na++Cl- | D. | NH3•H2O?NH4++OH- |
分析 A.盐酸为强酸完全电离出氢离子和氯离子;
B.H2CO3是二元弱酸,在水溶液里不能完全电离,分步电离;
C.NaCl为强电解质,在溶液中完全电离出钠离子和氯离子;
D.一水合氨是弱电解质,在水溶液里只有部分电离,电离出氢氧根离子和铵根离子.
解答 解:A.盐酸为强酸完全电离:HCl═H++Cl-,故A正确;
B.H2CO3是弱电解质,在水溶液里分步电离,电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-,故B错误;
C.NaCl为强电解质,在溶液中完全电离,电离方程式为:NaCl=Na++Cl-,故C正确;
D.一水合氨是弱电解质,在水溶液里部分电离,电离方程式为:NH3•H2O?NH4++OH-,故D正确;
故选B.
点评 本题主要考查学生电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,多元弱酸分步电离,题目难度不大.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题
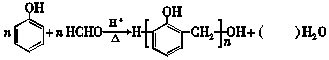
| A. | 方程式中水的化学计量数是 2n-1 | |
| B. | 常温下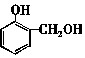 比 比 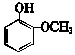 更难溶于水 更难溶于水 | |
| C. | 1 mol HCHO与银氨溶液反应最多可以生成2 mol Ag | |
| D. |  的单体是 的单体是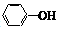 和HCHO 和HCHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
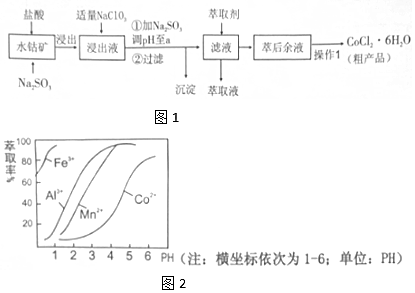
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(ClO-)=c(OH-) | B. | c(ClO-)+c(OH-)═c(Na+) | ||
| C. | c(OH-)═c(HClO)+c(H+) | D. | 2c(ClO-)+2c(HClO)═c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH:①>③>② | |
| B. | 水电离出的(H+):③>②>① | |
| C. | ①和②等体积混合后的溶液:c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | ①和③等体积混合后的溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com