
| A. | 简单离子半径:Z>Y | |
| B. | Z的单质保存在X2Y中 | |
| C. | ZYX溶液和ZXW溶液都呈碱性,且原理相同 | |
| D. | 室温下,0.01mol•L-1W的最高价含氧酸的酸式钠盐溶液的pH为2 |
分析 短周期主族元素X、Y、Z、W原子序数依次增大,其中r(Z)/r(X)(r表示原子半径)的值在短周期主族元素中最大,可知X为H,Z为Na元素;而W的核外电子总数是同族元素Y的2倍,则Y为O,W为S元素,以此来解答.
解答 解:由上述分析可知,X为H,Y为O,Z为Na,W为S,
A.具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径:Y>Z,故A错误;
B.钠与水反应,不能保存在水中,故B错误;
C.NaOH电离显碱性,NaHS水解显碱性,故C错误;
D.室温下,0.01mol•L-1W的最高价含氧酸的酸式钠盐溶液,为NaHSO4,电离出氢离子浓度为0.01mol•L-1,pH为2,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的性质、盐类水解、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
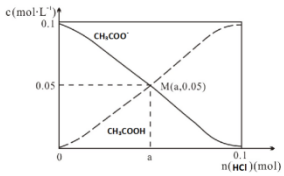
| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(H+)-n(OH-)=(0.05-a )mol | |
| C. | 随着HCl的加入,$\frac{c(O{H}^{-})}{c(C{H}_{3}COO{H}^{-})}$不断减小 | |
| D. | 当n(HCl)=0.1mol时,c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫单质在过量的空气中燃烧生成SO2 | |
| B. | 自然界的硫元素主要以硫化物和硫酸盐等形式存在,无硫单质 | |
| C. | 二氧化硫和氯气使品红溶液褪色的原理不相同 | |
| D. | 浓硫酸与碳在一定条件下的反应,体现了浓硫酸的强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验A | 条件 | 现象 |
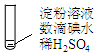 | 加热 | ⅰ.加热后蓝色褪去 ⅱ.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
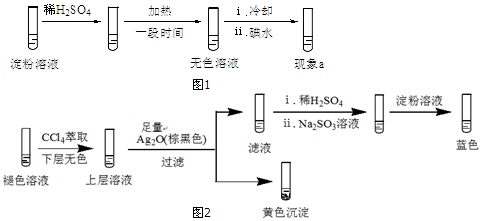
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳是酸雨的主要成分 | |
| B. | 氢气是一种理想的清洁燃料 | |
| C. | 碳酸氢钠可用于治疗胃酸过多 | |
| D. | 氯化铁溶液可用于制作印刷铜电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡 常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
| A. | 将0.1mol/L的醋酸加水不断稀释,c(CH3COO-)始终减小 | |
| B. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离予方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | 25℃,等浓度的CH3COOH、HClO、H2CO3和H2SO3溶液中,酸性最强的是HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棕红色的NO2加压后颜色先变深后变浅 | |
| B. | 由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 | |
| C. | 增大压强更有利于合成氨 | |
| D. | 硫酸工业上SO2氧化成SO3采用过量的空气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com