
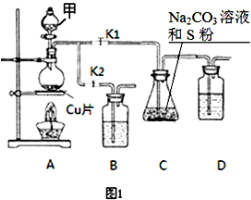
 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.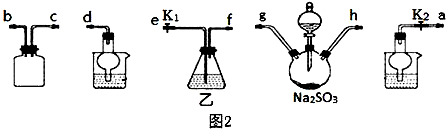
分析 (1)由实验装置可知,Na2SO3与硫磺(S)共煮可制得硫代硫酸钠,装置C中试剂为Na2CO3溶液和硫粉,所以试剂甲与铜片反应生成SO2,则试剂甲为浓硫酸,铜与浓硫酸反应生成硫酸铜和二氧化硫;
(2)①碳酸根,硫代硫酸根与氢离子不共存;
②装置B、D中应盛放氢氧化钠溶液,用来吸收SO2,防止污染环境;
(3)装置gh是浓硫酸和亚硫酸钠反应生成二氧化硫气体的装置,装置bc是安全瓶,导气管略露出胶塞,起到防止倒吸的作用,二氧化硫是污染性气体实验结束后不能排放到大气中,装置d中的反应结束后,先关闭分液漏斗旋塞,接下来的操作是关闭K1打开K2;
(4)装置乙中发生反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;
(5)Na2S2O3与氯气反应生成硫酸根;
(6)加入硝酸钡除掉硫酸根,然后检验氯离子.
解答 解:(1)由实验装置可知,Na2SO3与硫磺(S)共煮可制得硫代硫酸钠,装置C中试剂为Na2CO3溶液和硫粉,所以试剂甲与铜片反应生成SO2,则试剂甲为浓硫酸,铜与浓硫酸反应生成硫酸铜和二氧化硫,反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2SO2↑+2H2O;
(2)①碳酸根,硫代硫酸根与氢离子不共存,离子方程式:CO32-+2H+=H2O+CO2↑、S2O32-+2H+=H2O+SO2↑+S↓,
故答案为:CO32-+2H+=H2O+CO2↑、S2O32-+2H+=H2O+SO2↑+S↓;
②装置B、D中应盛放氢氧化钠溶液,用来吸收SO2,防止污染环境,故答案为:氢氧化钠溶液;
(3)装置gh是浓硫酸和亚硫酸钠反应生成二氧化硫气体的装置,装置bc是安全瓶,导气管略露出胶塞,起到防止倒吸的作用,二氧化硫是污染性气体实验结束后不能排放到大气中,装置d中的反应结束后,先关闭分液漏斗旋塞,接下来的操作是关闭K1打开K2,接口顺序为:a→g,h→b,c→e,f→d或 a→h,g→b,c→e,f→d,
故答案为:g、h、b、c、e、f或 h、g、b、c、e、f;
(4)装置乙中发生反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,盛装的试剂是Na2CO3和Na2S的混合溶液,
故答案为:Na2CO3和Na2S的混合溶液;
(5)Na2S2O3与氯气反应生成硫酸根,离子方程式为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,
故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(6)加入硝酸钡除掉硫酸根,然后检验氯离子.取少量反应后的溶液于试管中,滴入Ba(NO3)2溶液至不再产生沉淀,再取上层清液(或过滤后取滤液),滴加AgNO3溶液,若产生白色沉淀,则说明Cl2被还原为了Cl-,
故答案为:取少量反应后的溶液于试管中,滴入Ba(NO3)2溶液至不再产生沉淀,再取上层清液(或过滤后取滤液),滴加AgNO3溶液,若产生白色沉淀,则说明Cl2被还原为了Cl-.
点评 本题考查物质的制备,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养.


科目:高中化学 来源: 题型:多选题
| A. | 78g过氧化钠晶体中,含3NA个离子 | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 柠檬烯的分子式为C10H14 | |
| B. | 它的一氯代物有8种 | |
| C. | 它和丁基苯互为同分异构体 | |
| D. | 一定条件下,它分别可以发生加成、取代、氧化反应,但不能发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热,观察有无气体放出 | B. | 加入盐酸,观察有无气体放出 | ||
| C. | 加入澄清石灰水中观察有无沉淀 | D. | 加入CaCl2溶液观察有无沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NH4++H2O═NH3•H2O+H+ | D. | BaSO4(s)?Ba2+(aq)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60乙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HO3-和CO32-E离子数之和为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 同温、同压、同体积的CO和NO含有的质子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com