


| ||
| ||
| cmol/L×b×10-3L×250g?mol-1×5 |
| ag |
| cmol/L×b×10-3×250mol/L×5 |
| ag |


科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
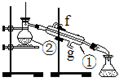
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 实验现象与结论 |
| 取少量干燥的蓝绿色固体于试管中, |
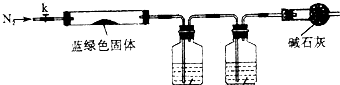
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁、四氧化三铁、冰水混合物 |
| B、金属钙、生石灰、碱石灰 |
| C、水银、空气、干冰 |
| D、二氧化硫、水蒸气、天然气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
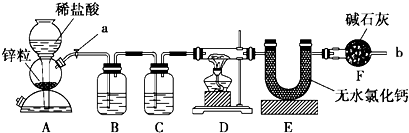
查看答案和解析>>
科目:高中化学 来源: 题型:
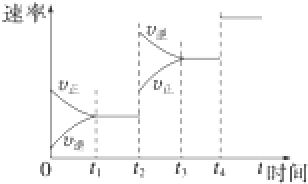
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、分液操作时,分液漏斗下层液体应从下口放出,上层液体应从上口倒出 |
| D、萃取操作时,所选萃取剂溶解溶质能力应大于原溶剂且与原溶剂互不相溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com