
分析 (1)铁离子的检验加KSCN溶液,如果变红说明药物变质;
(2)根据铝在空气容易形成致密的氧化物,因此抗腐蚀性能很好进行解答;
(3)点燃铝和氧化铁(Fe2O3)的混合物,生成氧化铝和熔融状态下的铁,写出反应的化学方程式即可.
解答 解:(1)铁离子的检验加KSCN溶液以观察溶液颜色的变化,如果变红说明药物变质,故答案为:KSCN溶液;溶液变黄;
(2)铝比铁活泼,但是铝制品比铁制品耐腐蚀,原因是:铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜从而阻止了内部的铝进一步氧化,故答案为:铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜从而阻止了内部的铝进一步氧化;
(3)点燃铝和氧化铁(Fe2O3)的混合物,生成氧化铝和熔融状态下的铁,反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
点评 本题考查铝和亚铁的化学性质和用途等方面的知识,可以依据已有的知识进行,比较容易.


科目:高中化学 来源: 题型:选择题
| A. | ②③⑥⑦ | B. | ①②④⑦ | C. | ②③④⑥ | D. | ②③⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
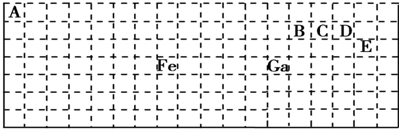
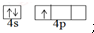 .
.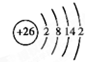
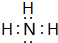 ,含有共价键化学键,E的电子表达式是
,含有共价键化学键,E的电子表达式是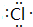 .
.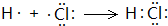 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LSO3所含分子数为0.1NA | |
| B. | 0.1 mol Fe与足量盐酸反应,转移的电子数为0.3 NA | |
| C. | 1molNa2O2与足量水反应转移的电子数为NA | |
| D. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的最高价氧化物对应的水化物的酸性比Y的强 | |
| B. | X的阴离子比Y的阴离子的还原性强 | |
| C. | X原子的得电子能力比Y原子强 | |
| D. | X的气态氢化物比Y的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
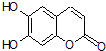 氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )
氢原子未画出),具有抗菌作用.若1mol七叶树内酯与NaOH溶液完全反应,则消耗的NaOH的物质的量为( )| A. | 2 mol | B. | 3 mol | C. | 4 mol | D. | 1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
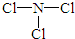 ;
;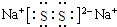 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用溴单质的氧化性可以把碘离子转化为碘单质 | |
| B. | 实验室常用NaOH溶液吸收多余的Cl2以避免污染 | |
| C. | Cl2不能使有色布条褪色,但Cl2具有氧化性 | |
| D. | 过量的红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com