
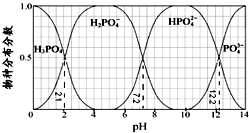
| A. | H3PO4的Ka3=10-12.2,HPO42-的水解平衡常数为10-6.8 | |
| B. | Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性 | |
| C. | 为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 | |
| D. | pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42-)>c(PO43-)>c(OH-)>c(H+) |
分析 A.根据电离方程式HPO42-?PO43-+H+,结合各物质的浓度计算,水解常数可以利用离子积常数、电离平衡常数计算得到;
B.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,生成Ca3(PO4)2沉淀,促进HPO42-的电离;
C.要获得尽可能纯的NaH2PO4,pH应控制在4~5.5之间;
D.由图象可知,在pH=13时,c(HPO42-)<c(PO43-).
解答 解:由图象可知横坐标每一小格代表0.5个pH单位,则
A.电离方程式为,H2PO4-?HPO42-+H+,则H3PO4的Ka2=$\frac{1{0}^{-7.2}×0.5}{0.5}$=10-7.2,电离方程式为,HPO42-?PO43-+H+,H3PO4的Ka3=$\frac{1{0}^{-12.2}×0.5}{0.5}$=10-12.2,HPO42-的水解平衡常数=$\frac{c(O{H}^{-})c({H}_{2}P{{O}_{4}}^{-})}{c(HP{{O}_{4}}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K{a}_{2}}$=$\frac{1{0}^{-14}}{1{0}^{-7.2}}$=10-6.8,故A正确;
B.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,生成Ca3(PO4)2沉淀,促进HPO42-的电离,溶液则显酸性,故B正确;
C.由图象可知,要获得尽可能纯的NaH2PO4,pH应控制在4~5.5之间,故C正确;
D.由图象可知,pH=12.25时,c(HPO42-)=c(PO43-),在pH=13时,c(HPO42-)<c(PO43-),故D错误;
故选D.
点评 本题考查酸碱混合的定性判断和计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握图象所给信息,为解答该题的关键,难度中等.


科目:高中化学 来源: 题型:解答题
 元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素组 | 例外元素 | 其他元素所属类型的编号 |
| (1)S、N、Na、Mg | N | ③ |
| (2)P、Sb、Si、As | Si | ④ |
| (3)Rb、B、Br、Fe | Fe | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
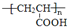
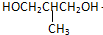 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$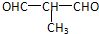 +2H2O;②E→M:2HOCH2CH2COOH $→_{△}^{浓H_{2}SO_{4}}$
+2H2O;②E→M:2HOCH2CH2COOH $→_{△}^{浓H_{2}SO_{4}}$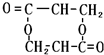 +2H2O;
+2H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 相关实验 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO3 | 稀硫酸、澄清的石灰水 | 产生使澄清石灰水变浑浊的无色无味气体的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 鉴别葡萄糖和蔗糖 | 银氨溶液 | 有银镜产生的是葡萄糖 |
| ④ | 鉴别AlCl3和MgCl2溶液 | 氨水 | 先产生白色沉淀,然后沉淀消失的是AlCl3溶液 |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 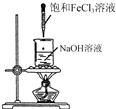 利用图所示操作制备氢氧化铁胶体 | |
| B. |  利用图所示装置制取NH3 | |
| C. | 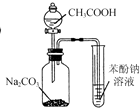 利用图所示装置证明H2CO3酸性强于苯酚 | |
| D. |  利用图所示装置制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
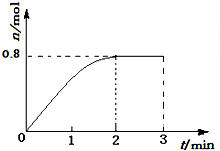 一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量如图.下列判断正确的是( )
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量如图.下列判断正确的是( )| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 该条件下此反应的化学平衡常数的数值约为0.91 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com