
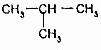
 的关系是同系物
的关系是同系物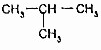 (异丁烷)的关系是同分异构体.
(异丁烷)的关系是同分异构体. 分析 (1)同种元素的不同种原子间互称为同位素;
(2)由同种元素形成额不同种单质间互称同素异形体;
(3)结构相似、在分子组成上相差一个或若干个CH2原子团的化合物互称同系物;
(4)分子式相同而结构不同的化合物互称同分异构体.
解答 解:(1)同种元素的不同种原子间互称为同位素,而${\;}_{6}^{12}$C和${\;}_{6}^{13}$C同为碳元素的两种碳原子,故互为同位素,故答案为:同位素;
(2)由同种元素形成的不同种单质间互称同素异形体,而金刚石、墨和C60均为碳元素的不同种单质,故为同素异形体,故答案为:同素异形体;
(3)结构相似、在分子组成上相差一个或若干个CH2原子团的化合物互称同系物,故CH3CH3和 互为同系物,故答案为:同系物;
互为同系物,故答案为:同系物;
(4)分子式相同而结构不同的化合物互称同分异构体,而CH3-CH2-CH2-CH3(正丁烷)和 (异丁烷)的分子式相同而结构不同,故互为同分异构体,故答案为:同分异构体.
(异丁烷)的分子式相同而结构不同,故互为同分异构体,故答案为:同分异构体.
点评 本题考查了同位素、同素异形体、同分异构体、同系物等概念,难度不大,注意这几个概念的区别.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤⑥⑦ | B. | ④⑤⑦ | C. | ②④⑤ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂是碱金属元素,可以保存在煤油中 | |
| B. | 铝离子和锂离子的核外电子排布相同 | |
| C. | Li+的半径大于H-的半径 | |
| D. | 短周期中能与强碱反应产生H2的金属元素是铝,在周期表中位于第ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
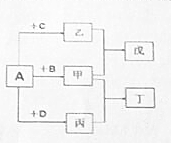 短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应.
短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应. ,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.
,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测0.1mol•L-1氨水的pH为11:NH3•H2O?NH${\;}_{4}^{+}$+OH- | |
| B. | 将Na块放入水中,放出气体:2Na+2H2O=2NaOH+H2↑ | |
| C. | 铝片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO${\;}_{2}^{-}$+3H2↑ | |
| D. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
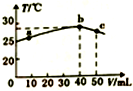
| A. | 25℃时,HA的电离平衡常数Ka约为1.43×10-3 | |
| B. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| C. | b→c的过程中,温度降低的主要原因是溶液中发生了吸热反应 | |
| D. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的原子序数比Y的小 | B. | X的原子半径比Y的大 | ||
| C. | X原子的最外层电子数比Y的大 | D. | X元素的最高正价比Y的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com