
| A. | NaOH溶液的pH小于氨水的pH | B. | NaOH溶液的pH大于氨水的pH | ||
| C. | 两溶液的pH相等 | D. | 无法判别两溶液pH的相对大小 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 分别取样配成溶液,滴加CaCl2溶液,观察有无白色沉淀 | |
| B. | 分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 | |
| C. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O?H++Cl-+HClO | B. | HCO3-+H2O?H3O++CO32- | ||
| C. | H2S?H++HS- | D. | NH4++2H2O?NH3•H2O+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li-Al在电池中作为负极材料,电极反应式:Li-e-=Li+ | |
| B. | 该电池的电池反应式为:2Li+FeS=Li2S+Fe | |
| C. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS | |
| D. | 放电时,Li+向正极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3的熔点高,可用作耐火材料 | |
| B. | NaHCO3与盐酸反应,可用于治疗胃酸过多 | |
| C. | SO2可污染环境,不可用于杀菌、消毒 | |
| D. | 二氧化氮、氨气、氯气和二氧化硫都是易液化的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
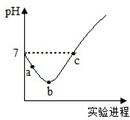 室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| C. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| D. | 由a点到b点的过程中,溶液中$\frac{c(Cl{O}^{-})}{c({H}^{+})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把30℃的硝酸钾饱和溶液加热到60℃,溶液的质量分数和物质的量浓度均增大 | |
| B. | 把60℃的硝酸钾饱和溶液降温到30℃,溶液仍饱和,溶液的质量分数和物质的量浓度均不变 | |
| C. | 60℃硝酸钾饱和溶液中含有的溶质的质量比30℃的硝酸钾饱和溶液中多 | |
| D. | 把30℃的硝酸钾饱和溶液加热到60℃,溶液的质量分数和物质的量浓度均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③④ | B. | 只有①②③④⑤ | C. | 只有②③④ | D. | 只有①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com