
����Ŀ����������Ҫ�ĵ��ʣ��Dz������Ļ���Ʒ֮һ����ϳ�ԭ��Ϊ��N2(g)+3H2(g)![]() 2NH3(g)�� ijͬѧΪ��̽��������������Ӧ���ɰ�������һ���¡������ܱ������г���1 mol N2��3 mol H2��Ϸ������з�Ӧ�����ж���1mol H2��Ҫ����436 kJ������������1 mol N2��Ҫ����945 kJ������������1 mol N-H������391 kJ��������
2NH3(g)�� ijͬѧΪ��̽��������������Ӧ���ɰ�������һ���¡������ܱ������г���1 mol N2��3 mol H2��Ϸ������з�Ӧ�����ж���1mol H2��Ҫ����436 kJ������������1 mol N2��Ҫ����945 kJ������������1 mol N-H������391 kJ��������
(1)д��NH3�ĵ���ʽ___________________��
(2)�÷�Ӧ________(����ա��ų���)����______________��
(3)����Ӧ�ﵽƽ��ʱ��N2��H2��ת����֮��Ϊ____________��
���𰸡�![]() �ų� 93kJ 1:1
�ų� 93kJ 1:1
��������
(1)NH3��ÿ����͵�����һ�Ե��ӣ����й¶Ե��ӡ�
(2)���㷴Ӧ�ϼ����յ������ͳɼ��ų������������߱Ƚϡ�
(3)�������֮�ȵ��ڼ���ϵ��֮��ʱ������Ӧ�ﵽƽ��ʱ��N2��H2��ת������ȡ�
(1) NH3��ÿ����͵�����һ�Ե��ӣ����й¶Ե��ӣ����NH3�ĵ���ʽ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(2)�÷�Ӧ�ϼ����յ�����Ϊ436 kJ ��3 + 945 kJ = 2253 kJ���ɼ��ų�������Ϊ391 kJ ��6 = 2346 kJ���ɼ��ų����������ڶϼ����յ���������˷�Ӧ�Ƿų�����2346 kJ 2253 kJ = 93 kJ���ʴ�Ϊ���ų���93 kJ��
(3)�������֮�ȵ��ڼ���ϵ��֮��ʱ������Ӧ�ﵽƽ��ʱ��N2��H2��ת������ȣ����N2��H2��ת����֮��Ϊ1:1���ʴ�Ϊ��1:1��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ѧԺ�����Ƚ������о�Ժ�з���һ����������ʯīϩ˫���ӵ��(AGDIB���)���õ�����������������(LiPF6)��̼�������ܼ�Ϊ���Һ���ŵ�ʱ�Ͻ�AlLi����ȥ�Ͻ�Ӧ��������(PF��)��ʯīϩCx����Ƕ������������Һ���ŵ�ʱ�乤��ԭ����ͼ��ʾ������˵��������ǣ� ��
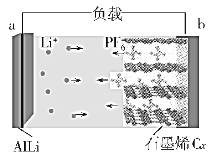
A.�õ�ز�����ˮ��Ϊ�������Һ
B.�ŵ�ʱ��a�缫�ĵ缫��ӦʽΪAlLi��e-=Li++Al
C.���ʱ��b�缫�ĵ缫��ӦʽΪPF6-��e-+Cx=CxPF6
D.�Ͼ�AGDIB��ؽ������ŵ紦����ʱ����ת��1mole-����ɻ���7gLi
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ�~���ڱ��е�λ�ã�����ѧ�����ش��������⣺
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
1 | �� | |||||||
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | �� |
��1������ЩԪ���У���ѧ��������õ�Ԫ�ص�ԭ�ӽṹʾ��ͼΪ___���γɵĵ����ǰ뵼�����___����Ԫ�����ƣ���
��2��������γɵĻ�����ĵ���ʽΪ___��������γɵ��������ĽṹʽΪ___��
��3
��4����̬�⻯�����ȶ�����___���ѧʽ�����ڡ��ۡ����ԭ�Ӱ뾶��С��__�����ط��ţ���
��5��������γɵĻ����������___���������ӻ��������������ۻ������������þ�������___���壨������������������������ԭ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˼ά�ǻ�ѧ�����г��õ�һ��˼ά�����������й����ӷ���ʽ��������ȷ����( )
��֪ | ���� | |
A | ��Fe����CuSO4��Һ��Fe+Cu2+=Cu+Fe2+ | ��Na���뵽CuSO4��Һ��2Na+Cu2+=Cu+2Na+ |
B | ��Ca(ClO)2��Һ��ͨ������CO2 Ca2++2ClO-+CO2+H2O=CaCO3��+2HClO | ��Ca(ClO)2��Һ��ͨ������SO2 Ca2++2ClO-+SO2+H2O=CaSO3��+2HClO |
C | �ö��Ե缫���NaCl��Һ 2Cl-+2H2O | �ö��Ե缫���MgBr2��Һ 2Br-+2H2O |
D | ϡ������NaOH��Һ��Ӧ������ H++OH-=H2O | ϡHNO3��Ba(OH)2��Һ��Ӧ������ H++OH-=H2O |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��һ��ɱ������Ч�ʸߡ�������ȾС��ˮ��������ʵ�����п�ͨ�����·�Ӧ�Ƶã�2KClO3��H2C2O4��H2SO4![]() 2ClO2����K2SO4��2CO2����2H2O������˵������ȷ������ ��
2ClO2����K2SO4��2CO2����2H2O������˵������ȷ������ ��
A��CO2����������
B��H2C2O4�ڷ�Ӧ�б�����
C��H2C2O4��������ǿ��ClO2��������
D��ClO2��ˮ������ʱ����������ǿ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������㷺Ӧ���ڵ����մɵȹ�ҵ������һ�������£�AlN��ͨ����Ӧ��Al2O3��N2��3C![]() 2AlN��3CO�ϳɡ�����������ȷ����
2AlN��3CO�ϳɡ�����������ȷ����
A. AlN�е��Ļ��ϼ�Ϊ+3B. ������Ӧ�У�ÿ����1 mol AlN��ת��3 mol����
C. AlN��Ħ������Ϊ41 gD. ������Ӧ�У�N2�ǻ�ԭ����Al2O3��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صij������ϼ���ԭ�������Ĺ�ϵͼ����ش�
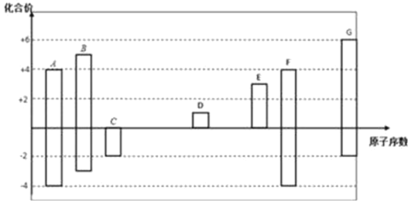
(1)Ԫ��F�����ڱ��е�λ����___________________________��
(2)C2����D+��G2�����Ӱ뾶��С˳����______________(�����ӷ��Żش�)��
(3)C��G���⻯���У��е�ϵ͵���______(�ѧʽ)��
��Ϊ____________________________________________��
(4)A��C�γɻ�����AC2�ĽṹʽΪ_______________��D������������ˮ����ĵ���ʽΪ___________________��
(5)�õ���ʽ��ʾD��GԪ���γɻ�����Ĺ���______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��NaHSO4��Һ�еμ�NaHSO3��Һ�����ӷ�Ӧ����ʽΪ��_____�����Ǹļ�����������Һ�����ԣ����ӷ�Ӧ����ʽΪ��______��
(2)��1L 1mol/L��NH4Al��SO4��2��Һ�еμ�2.25L ��Ũ�ȵ�Ba(OH)2��Һ�����ӷ�Ӧ����ʽΪ��__��
(3)��FeI2��FeBr2��1mol �Ļ��Һ��ͨ������2.5 mol�����ӷ�Ӧ����ʽΪ��____��
(4)��ѧ�ڻ�������������ʮ����Ҫ�����ã���������������������ˮ�������ε���Ⱦ��������������H2�ܽ�NO3����ԭΪN2��������Ӧ�����ӷ���ʽΪ___��
(5)����I2�������Կɲⶨ��������ĺ����������ǽ������е���ת����H2SO3��Ȼ����һ��Ũ�ȵ�I2��Һ���еζ����ζ���Ӧ�����ӷ���ʽΪ____��
(6) Fe��һ�ֺ������FeO42������ǿ�����ԣ�����������Һ�м���ϡ���ᣬ��Һ��Ϊ��ɫ��������ɫ����������÷�Ӧ�����ӷ���ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeCl3��Һ�м���Na2SO3��Һ,�ⶨ��Ϻ���ҺpH����ǰ��Һ��![]() �仯��������ͼ��ʾ��
�仯��������ͼ��ʾ��
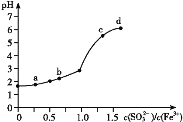
ʵ�鷢��:
��.a����Һ������,�����еμ�NaOH��Һ��,���������Ұ�ɫ����,����KSCN��Һ�Ժ�ɫ;
��.c���d����Һ�в������ɫ����,�������ݳ���ȡ���ϲ���Һ�μ�NaOH��Һ������������,�μ�KSCN��Һ�Ժ�ɫ��
�������������
A.��a����Һ�еμ�BaCl2��Һ,����������
B.b���a����ҺpH���ߵ���Ҫԭ��:2Fe3++SO32-+H2O2Fe2++SO42-+2H+
C.c����Һ�з�������Ҫ��Ӧ:2Fe3++3 SO32-+6H2O![]() 2Fe(OH)3+3H2SO3
2Fe(OH)3+3H2SO3
D.��d���ϲ���Һ�еμ�KSCN��Һ,��Һ���;�ٵμ�NaOH��Һ,��ɫ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com