
| A. | 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN- | |
| B. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=106的溶液中:NH4+、K+、AlO2-、NO3- | |
| C. | 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl- | |
| D. | 1.0 mol•L-1的KNO3溶液中:Fe2+、H+、Cl-、I- |
分析 A.离子之间结合生成络离子;
B.$\frac{c(O{H}^{-})}{c({H}^{+})}$=106的溶液,显碱性;
C.能使甲基橙变红的溶液,显酸性;
D.离子之间发生氧化还原反应.
解答 解:A.Fe3+、SCN-结合生成络离子,不能大量共存,故A不选;
B.$\frac{c(O{H}^{-})}{c({H}^{+})}$=106的溶液,显碱性,不能大量存在NH4+,故B不选;
C.能使甲基橙变红的溶液,显酸性,该组离子之间不反应,可大量共存,故C选;
D.Fe2+(或I-)、H+、NO3-发生氧化还原反应,不能大量共存,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,综合性较强,题目难度不大.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 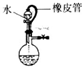 说明该装置气密性良好 | |
| B. | 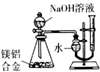 测定镁铝合金中铝的质量分数 | |
| C. | 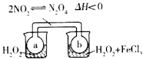 瓶中气体颜色变深,说明H202分解是吸热反应 | |
| D. | 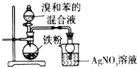 验证苯和溴发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前36号元素A、B、C、D的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C最外层电子数是电子层数的三倍.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均全充满.请回答下列问题:
前36号元素A、B、C、D的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C最外层电子数是电子层数的三倍.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均全充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素周期表中钠元素的信息如图所示,对图中信息理解不正确的是( )
元素周期表中钠元素的信息如图所示,对图中信息理解不正确的是( )| A. | 质子数为11 | B. | 元素名称为钠 | ||
| C. | 元素符号为 Na | D. | 核外电子数为22.99 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 下列有关说法正确的是( )
下列有关说法正确的是( )| A. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)将减小 | |
| B. | 一定温度下,反应“2HI(g)=H2(g)+I2(g)△H>0”能自发进行,则该反应△S>0 | |
| C. | 向滴有酚酞的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去,说明BaCl2溶液显酸性 | |
| D. | 如图电池放电时的正极反应式:2Li++Li2O2+2e-=2Li2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢是用量最大,用途最广的合金 | |
| B. | 苯酚沾到皮肤上,应立即用大量的热水冲洗 | |
| C. | 利用高纯单质硅,可以制成光电池 | |
| D. | 含氯,溴的氟代烷可对臭氧层产生破坏作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图的键线式表示烃的名称为:3-甲基-4-乙基-7-甲基辛烷 | |
| B. | 符合分子式为C3H8O的醇有三种不同的结构 | |
| C. | 乙烯在一定条件下能发生加成反应,加聚反应,被酸化高锰酸钾溶液氧化,也能在一定条件下被氧气氧化成乙酸 | |
| D. |  治疗疟疾的青蒿素(如图),分子式是C15H20O5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com