
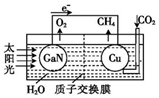
 科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法不正确的是( )
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法不正确的是( )| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | GaN表面发生氧化反应:2H2O-4 e-═O2↑+4H+ | |
| C. | Cu表面的反应是:CO2+8e-+6H2O═CH4+8OH? | |
| D. | H+透过质子交换膜从左向右迁移 |
分析 该装置中,根据电子流向知,GaN是负极、Cu是正极,负极反应式为:2H2O-4e-=4H++O2↑,正极反应式为:CO2+8e-+8H+=CH4+2H2O,电解质溶液中阳离子向正极移动,据此分析解答.
解答 解:A.根据图示可知,该装置中将太阳能转化为化学能的过程,故A正确;
B.负极发生氧化反应,负极反应式为:2H2O-4e-=4H++O2↑,故B正确;
C.根据电子流向知,Cu是正极,正极上二氧化碳得电子和氢离子反应生成甲烷,电极反应式为:CO2+8e-+8H+=CH4+2H2O,故C错误;
D.放电时,电解质溶液中阳离子向正极移动,所以装置中的H+由左向右移动,故D正确;
故选C.
点评 本题考查化学电源新型电池,题目难度中等,明确原电池原理为解答根据,注意正确判断电极反应、电子流向、离子流向,难点是电极反应式的书写.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:多选题
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| A | 向某无色溶液中滴加盐酸 | 产生能使澄清石灰水变浑浊气体 | 说明溶液中一定含有CO32- |
| B | 向某无色溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 说明溶液中一定含有SO42- |
| C | 向某溶液中先滴加KSCN溶液,再滴加氯水 | 先无明显现象,后出现血红色溶液 | 说明溶液中一定含有Fe2+ |
| D | 向一定浓度的Na2SiO3溶液中通入适量的CO2 | 出现白色沉淀 | 说明H2CO3的酸性比H2SiO3强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸和硝酸是重要的工业原料,工业上可用于制化肥、农药、和炸药 | |
| B. | 石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料 | |
| C. | 因为氨易液化,在汽化时会吸收大量的热量,所以可作制冷剂 | |
| D. | SO2和氯水遇到紫色石蕊试液都先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 C、Si是构成无机非金属材料的重要元素.
C、Si是构成无机非金属材料的重要元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.
H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.| 初始pH | pH=10 | pH=12 |
| 1小时后H2O2溶液浓度 | 0.13mol•L-1 | 0.07mol•L-1 |
| 1小时后pH | 没有明显变化 | 没有明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的沸点高于丙烷 | |
| B. | 油脂和蛋白质都是高分子化合物 | |
| C. | CH2=C(CH3)2的名称是2-甲基-2-丙烯 | |
| D. | 对二甲苯的核磁共振氢谱有4个吸收峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
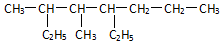 的系统命名为3,4-二甲基-5-乙基辛烷.若该烷烃是由某炔烃与H2发生加成反应而得到的产物,则符合题意的炔烃分子有4种.
的系统命名为3,4-二甲基-5-乙基辛烷.若该烷烃是由某炔烃与H2发生加成反应而得到的产物,则符合题意的炔烃分子有4种. ,现有一种有机物X的键线式如图所示:
,现有一种有机物X的键线式如图所示: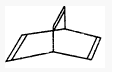
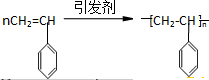 .
.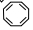 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2gO2和O3的混合物中含有的氧原子数目为0.2NA | |
| B. | 1L0.1mol/L的醋酸溶液中含有氢离子数目为0.1NA | |
| C. | 标准状况下,2.24LCCl4含碳原子数目为0.1NA | |
| D. | 将5.85 g NaCl固体溶解在100 mL水中,得到溶液中c(Na+)=1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com